Malformations – Effets tératogènes des herbicides à base de glyphosate : divergence entre les décisions réglementaires et les preuves scientifiques

Auteurs : M Antoniou1 , MEM Habib2 , CV Howard3 , RC Jennings4 , C Leifert5 , RO Nodari6 , CJ Robinson7 * et J Fagan8 *
1 Chef du groupe Expression génétique et thérapie, département de génétique médicale et moléculaire, King’s College London School of Medicine, Royaume-Uni
2 Professeur d’entomologie, ancien directeur de l’Institut de biologie de l’UNICAMP et ancien vice-recteur chargé de la formation continue et des relations communautaires à l’UNICAMP, São Paulo, Brésil
3 Professeur, Centre des sciences biologiques moléculaires, Université d’Ulster, Irlande du Nord
4 Chercheur affilié, Département d’histoire et de philosophie des sciences, Université de Cambridge, Royaume-Uni
5 Professeur chargé du développement de la recherche en agriculture écologique à l’université de Newcastle, Royaume-Uni. Centres d’intérêt : directeur et administrateur du Stockbridge Technology Centre Ltd (STC),
Royaume-Uni
6 Professeur, Centre des sciences agricoles (département des sciences végétales), Université fédérale de Santa Catarina, Brésil
7Directeur de recherche, Earth Open Source, Londres, Royaume-Uni. Centres d’intérêt : rédacteur en chef, GM Watch, Royaume-Uni
8 Directeur, Earth Open Source. Centres d’intérêt : employé dans une entreprise de test et de certification des OGM
Traduction par Sabine Grataloup de la publication Teratogenic Effects of Glyphosate-Based Herbicides: Divergence of Regulatory Decisions from Scientific Evidence parue dans la revue Environmental & Analytical Toxicology en 2012
AVERTISSEMENT : cette traduction n’est fournie qu’à titre indicatif, le texte de référence de cette étude est celui d’origine en anglais dont le lien est fourni ci-dessus.
Mots-clé : Glyphosate ; Roundup ; Tératogénicité ; Effets tératogènes ; Malformations ; Évaluation des risques ; Toxicité reproductive
Citation: Antoniou M, Habib MEM, Howard CV, Jennings RC, Leifert C, et al. (2012) Teratogenic Effects of Glyphosate-Based Herbicides: Divergence of Regulatory Decisions from Scientific Evidence. J Environ Anal Toxicol S4:006. doi:10.4172/2161-0525.S4-006
Résumé
La publication d’une étude en 2010, montrant qu’une formulation d’herbicide à base de glyphosate et le glyphosate seul provoquaient des malformations chez les embryons de Xenopus laevis et de poulets en perturbant la voie de signalisation de l’acide rétinoïque, a suscité une controverse scientifique et réglementaire. Le débat s’est concentré sur les effets de la production et de la consommation de soja génétiquement modifié Roundup Ready®, conçu pour tolérer l’application d’herbicide à base de glyphosate.
Cette étude, ainsi que d’autres indiquant les effets tératogènes et reproductifs de l’exposition à l’herbicide à base de glyphosate, a été réfutée par l’Office fédéral allemand de la protection des consommateurs et de la sécurité alimentaire (BVL), ainsi que dans des articles financés par l’industrie. Ces réfutations s’appuyaient en partie sur des études non publiées commandées par l’industrie à des fins réglementaires, qui, selon elles, montraient que le glyphosate n’était pas un agent tératogène ou une toxine reproductive.
Cependant, l’examen du projet de rapport d’évaluation des autorités allemandes sur les études industrielles, qui sous-tend l’autorisation du glyphosate dans l’UE, a révélé de nouvelles preuves de la tératogénicité du glyphosate.
Bon nombre des malformations constatées étaient du type défini dans la littérature scientifique comme étant associées à la tératogenèse de l’acide rétinoïque.
Néanmoins, les autorités allemandes et européennes ont minimisé ces résultats dans leur évaluation et ont fixé une dose journalière admissible (DJA) potentiellement dangereuse pour le glyphosate.
Le présent document passe en revue les preuves relatives à la tératogénicité et à la toxicité reproductive des herbicides à base de glyphosate et conclut qu’une nouvelle évaluation des risques transparente doit être réalisée.
Cette nouvelle évaluation doit prendre en compte toutes les données relatives à la toxicité du glyphosate et de ses formulations commerciales, y compris les données générées par des scientifiques indépendants et publiées dans la littérature scientifique évaluée par des pairs, ainsi que les études financées par l’industrie.
Introduction
Une étude (Paganelli et al.) sur la toxicité d’une formulation commerciale de l’herbicide Roundup®et de son ingrédient actif, le glyphosate, a révélé que ces substances provoquaient de graves malformations chez les embryons de la grenouille à griffes sud-africaine Xenopus laevis et chez les poulets. Chez les
grenouilles, des dilutions de 1/5000 de la formulation (équivalentes à 430 μM de glyphosate) ont suffi à induire des malformations, notamment un raccourcissement de l’axe antéro-postérieur, une microcéphalie, une microphtalmie, une cyclopie et des malformations craniofaciales au stade de têtard. Les embryons injectés avec du glyphosate pur ont présenté des phénotypes similaires, ce qui suggère que c’est le glyphosate lui-même, plutôt qu’un tensioactif ou un autre adjuvant présent dans la formulation, qui était responsable de ces anomalies du développement. Le Roundup® a produit des effets similaires chez les embryons de poulet, qui ont présenté une perte des domaines rhombomères, une réduction des vésicules optiques et une microcéphalie.
Grâce à l’utilisation de tests de gènes rapporteurs et au sauvetage phénotypique par l’administration d’un antagoniste, les auteurs ont confirmé que le mécanisme par lequel le glyphosate et le Roundup provoquaient les effets tératogènes observés chez les embryons de Xenopus passait par la perturbation de la voie de signalisation de l’acide rétinoïque. Cela a entraîné une dérégulation des gènes régulateurs shh, slug et otx2, qui sont essentiels au développement du système nerveux central [1]. Bien qu’il ne s’agisse pas d’une étude toxicologique classique, cette étude est pertinente pour l’évaluation des risques chez l’homme, car la voie de signalisation de l’acide rétinoïque est une voie de signalisation centrale dans le développement embryonnaire qui fonctionne chez pratiquement tous les vertébrés, qu’il s’agisse d’amphibiens, d’oiseaux ou de mammifères.
Autres études montrant des malformations dues à l’exposition au glyphosate et au Roundup
L’étude de Paganelli et al. fait partie des nombreuses études qui ont mis en évidence des malformations liées à l’exposition au glyphosate et au Roundup.
Jayawardena et al. (2010) ont constaté près de 60 % de malformations chez les têtards de la rainette Polypedates cruciger traités avec une concentration de Roundup de 1 ppm, pertinente sur le plan environnemental. Les effets observés comprenaient une cyphose, une scoliose et un oedème [2]. Relyea (2012) a constaté que des concentrations de Roundup pertinentes sur le plan environnemental induisaient des queues relativement plus longues, similaires aux changements adaptatifs causés par la présence d’un prédateur chez les têtards de la grenouille des bois (Rana sylvatica ou Lithobates sylvaticus) et de la grenouille léopard (R. pipiens ou L. pipiens) [3].
Une étude sur les têtards de Scinax nasicus (Lajmanovich et al., 2005) a révélé que l’exposition à l’herbicide glyphosate provoquait des malformations craniofaciales et buccales, des anomalies oculaires et des queues courbées, ainsi que la mortalité. Les malformations et la mortalité augmentaient avec la dose et la durée d’exposition.
Une exposition de deux jours à 3,07 mg/l d’herbicide à base de glyphosate n’a causé que 10 % de mortalité, mais a provoqué des malformations chez 55 % des animaux testés [4].
Des malformations ont également été observées chez des mammifères traités avec des herbicides à base de glyphosate. Une étude toxicologique menée par Dallegrave et al. (2003) a révélé que les descendants de rates gravides ayant reçu des doses de 500, 750 et 1 000 mg/kg de Roundup entre le 6e et le 15e jour après la fécondation présentaient davantage d’anomalies squelettiques, y compris à des doses qui n’étaient pas toxiques pour la mère. Les malformations consistaient en l’absence d’os ou de parties d’os, des os raccourcis et courbés, des asymétries, des fusions et des fentes. Le pourcentage de foetus altérés augmentait avec la dose. Les auteurs ont conclu que le produit formulé était plus toxique que le glyphosate technique évalué par l’Organisation mondiale de la santé [5] et testé dans les études de tératogénicité financées par l’industrie décrites dans le projet de rapport d’évaluation sur le glyphosate publié en Allemagne en 1998.
Controverse scientifique et politique en Europe
En Europe, la publication en 2010 de l’étude de Paganelli et al. [1] a coïncidé avec une inquiétude croissante concernant les 40 millions de tonnes de soja importées chaque année, principalement pour nourrir le bétail. Une grande partie de ce soja est de la variété génétiquement modifiée (GM) Roundup Ready® [6], conçue pour tolérer l’application de l’herbicide glyphosate. Le débat scientifique et politique s’est poursuivi pendant de nombreuses années sur les conséquences sanitaires, environnementales et socio-économiques de la culture du soja GM dans les pays producteurs [7]. Plus récemment, les préoccupations se sont étendues aux risques potentiels pour la santé animale et humaine posés par les résidus de glyphosate dans l’alimentation animale et la chaîne alimentaire humaine [8,9]. Des résidus pouvant atteindre 17 mg/kg de glyphosate ont été trouvés dans les récoltes de soja [10].
L’autorisation actuelle du glyphosate par l’UE datant de 2002 [11] et étant valable pour dix ans, un nouvel examen était prévu en 2012. En réponse à une question parlementaire, John Dalli, commissaire européen chargé de la santé et de la politique des consommateurs, a déclaré que la date pourrait être avancée si de
nouvelles preuves le justifiaient [12].
Réaction des autorités allemandes et de l’industrie
Le commissaire Dalli a confié aux autorités réglementaires allemandes la tâche d’évaluer les conclusions de Paganelli et al. En tant qu’État membre « rapporteur » pour le glyphosate, l’Allemagne était chargée d’assurer la liaison entre l’industrie, la Commission européenne et les États membres dans le cadre du processus d’autorisation. En octobre 2010, l’Office fédéral allemand de la protection des consommateurs et de la sécurité alimentaire (BVL) a publié une réfutation anonyme de l’étude, dans laquelle il déclarait :
Il existe une base de données vaste et fiable sur la toxicité du glyphosate pour le développement et aucune preuve de tératogénicité n’a été obtenue. En particulier, les études menées sur des rats et des lapins n’ont pas révélé de malformations craniofaciales comme … on pourrait s’y attendre si une substance affectait principalement la crête neurale [13].
Bien que l’identité de cette « base de données vaste et fiable » ne soit pas définie par le BVL, les études sur les rats et les lapins auxquelles le BVL fait référence sont celles commandées par les fabricants d’herbicides à base de glyphosate et résumées dans le projet de rapport d’évaluation allemand de 1998 sur le glyphosate. Le résumé et les commentaires de l’Allemagne sur ces études largement inédites, non évaluées par des pairs et financées par l’industrie, figurant dans le projet de rapport d’évaluation, constituent la base de l’autorisation actuelle du glyphosate par l’UE, qui date de 2002 [11].
Le BVL a conclu que les conclusions de Paganelli et al. « ne remettent pas en cause l’évaluation actuelle des risques liés au glyphosate et aux PPP à base de glyphosate [produits phytosanitaires – pesticides] en ce qui concerne la santé humaine » [13].
Sur la base de l’évaluation du BVL, le commissaire Dalli a déclaré qu’il n’était pas nécessaire de restreindre ou d’interdire le glyphosate [14]. La Commission n’a pas avancé la révision du glyphosate, ni même respecté la date prévue de 2012. Au lieu de cela, elle a publié en novembre 2010 une directive reportant la révision du glyphosate à 2015 [15]. En réponse à une question de Friends of the Earth Germany sur les raisons de ce report, le BVL a répondu que la Commission et l’Autorité européenne de sécurité des aliments (EFSA) avaient une charge de travail trop importante pour examiner le glyphosate et n’avaient pas finalisé les règles relatives au renouvellement de l’autorisation de certains pesticides, dont le glyphosate (communication personnelle du BVL à Friends of the Earth Germany).
La réponse du BVL à Paganelli et al. a été suivie en 2011 par une réponse similaire de l’industrie. Des employés de Monsanto, Dow et Syngenta, tous fabricants d’herbicides à base de glyphosate, ont publié une lettre dans la même revue qui avait publié l’article original de Paganelli et al. [16]. La lettre de Monsanto/Dow/Syngenta, publiée parallèlement à une réponse d’Andres Carrasco, auteur principal de l’article de Paganelli et al. [17], déclarait : « Le glyphosate ne provoque pas d’effets néfastes sur la reproduction chez les animaux adultes ni de malformations congénitales chez les descendants de ces adultes exposés au glyphosate, même à des doses très élevées » [16].
Evaluation des allégations d’absence de tératogénicité
Afin de vérifier l’affirmation du BVL selon laquelle les études industrielles sur le glyphosate ne montrent aucune tératogénicité, nous avons obtenu des autorités allemandes le projet de rapport d’évaluation sur le glyphosate qu’elles ont rédigé en 1998.
Les données toxicologiques industrielles résumées dans le projet de rapport d’évaluation ne sont pas accessibles au public et sont considérées par Monsanto comme confidentielles sur le plan commercial, bien que le Pesticide Action Network Europe ait engagé une procédure judiciaire pour obtenir leur divulgation (communication personnelle).
L’examen du projet de rapport d’évaluation a révélé que les études toxicologiques de l’industrie sur des lapins et des rats qui, selon le BVL, ne montraient « aucune preuve de tératogénicité », faisaient en fait état de malformations dues à l’exposition au glyphosate [12].
Dans le projet de rapport d’évaluation, les autorités allemandes ont conclu, sur la base des études industrielles, que « le glyphosate n’est pas tératogène », mais ont ajouté que des doses plus élevées de glyphosate entraînaient « une réduction de l’ossification et une incidence plus élevée d’anomalies squelettiques et/ou viscérales » chez les foetus de rats et de lapins, ainsi qu’une diminution du nombre de foetus viables [18]. Ce dernier point correspond à une incidence accrue de malformations.
Les autorités allemandes ne précisent pas ce qu’elles entendent par « doses plus élevées », mais les études de tératogénicité financées par l’industrie utilisent généralement trois doses : faible, moyenne et élevée. Pour plus de détails sur les niveaux de dose utilisés, voir le tableau 1.
Cependant, dans les études financées par l’industrie, des malformations ont été observées non seulement à des doses élevées, toxiques pour la mère, comme l’a indiqué la DG SANCO, la direction générale de la santé et des consommateurs de la Commission, dans son rapport d’évaluation de 2002 sur le glyphosate [11], mais également à des doses plus faibles. Dans certains cas, les effets à des doses plus faibles étaient statistiquement significatifs [12], bien qu’il soit difficile d’obtenir une signification statistique à des doses plus faibles dans les études standardisées menées par l’industrie à des fins réglementaires, qui utilisent un petit nombre d’animaux par groupe.
Le tableau 1 ci-dessous présente l’éventail des malformations constatées dans les études de tératogénicité menées par l’industrie sur le glyphosate, telles que résumées par les autorités allemandes dans le projet de rapport d’évaluation. Ces études ont été réalisées dès les années 1980 et 1990.
Tableau 1
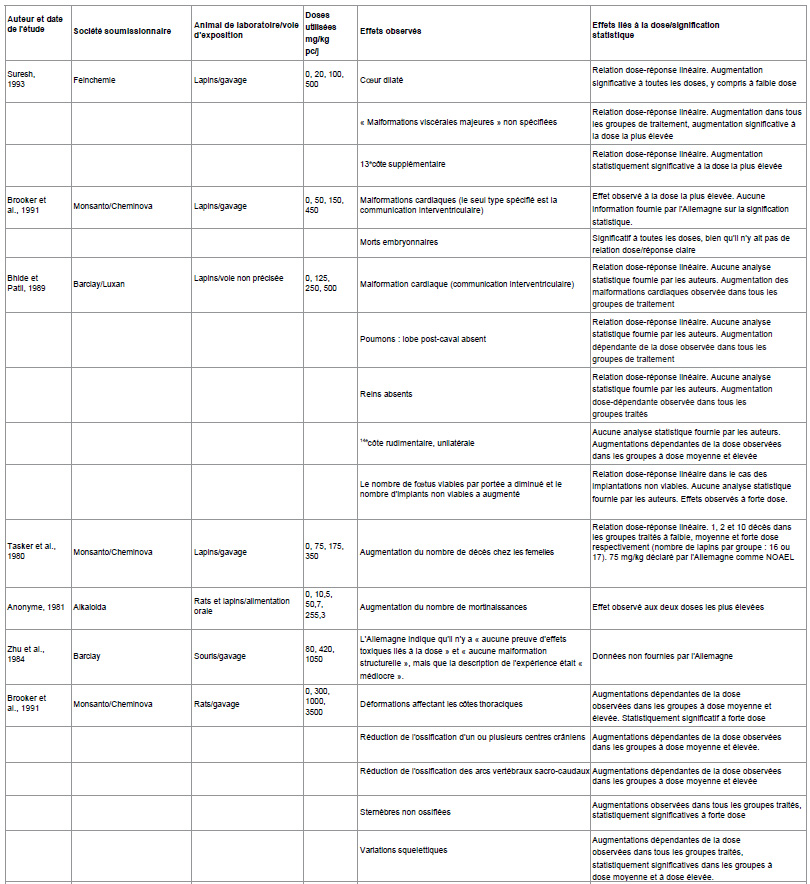
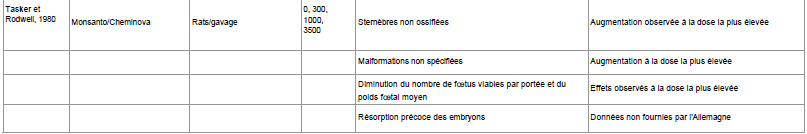
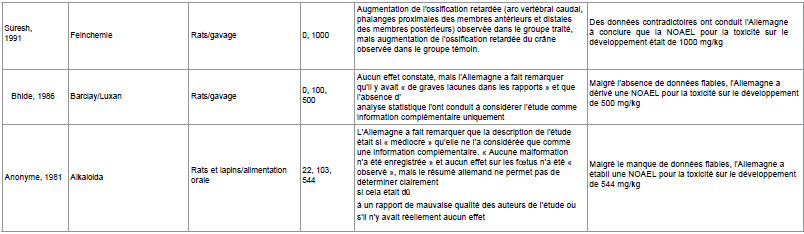
Source pour toutes les études : État membre rapporteur Allemagne (1998) Monographie sur le glyphosate, Agence fédérale allemande pour la protection des consommateurs et la sécurité alimentaire (BVL). Vol. 3-1 Glyphosat 05 : pp. 9-20
Tableau 1 : Malformations, morts embryonnaires et morts maternelles dans les études de tératogénicité sur le glyphosate financées par l’industrie.
Bon nombre des malformations constatées correspondent aux descriptions de la tératogenèse induite par l’acide rétinoïque dans la littérature. Par exemple, l’augmentation des malformations et anomalies cardiaques mentionnée dans le projet de rapport d’évaluation est citée comme caractéristique de la tératogénicité induite par l’acide rétinoïque par Lammer et al. [19], Kessel [20] et Huang et al. [21]. Les côtes surnuméraires, déformées et rudimentaires mentionnées dans le projet de rapport d’évaluation correspondent à la citation de Kessel (1992) selon laquelle la formation de côtes surnuméraires et les malformations costales sont caractéristiques de la tératogénicité induite par l’acide rétinoïque [20]. L’absence de lobe post-caval des poumons, mentionnée dans le projet de rapport d’évaluation, correspond à la dysmorphogenèse pulmonaire causée par l’administration ou la privation d’acide
rétinoïque, telle que citée par Malpel [22], Wilson et al. [23], Shenefelt [24] et Dickman et al. [25]. La réduction de l’ossification des centres crâniens et des arcs vertébraux sacro-caudaux, ainsi que les malformations squelettiques indéfinies, citées dans le projet de rapport d’évaluation, sont compatibles avec les malformations crâniennes et squelettiques citées par Lammer et al. [19], Kessel [20] et Huang et al. [21] comme caractéristiques de la tératogénicité induite par l’acide rétinoïque.
Observations générales sur le projet de rapport d’évaluation
Toxicité maternelle
Tout au long du projet de rapport d’évaluation, les autorités réglementaires allemandes ont rejeté les conclusions des études industrielles faisant état de malformations, affirmant que ces effets étaient dus à la toxicité maternelle. Dans son rapport de 2002, qui sert de base à l’autorisation du glyphosate par l’UE, la direction générale de la santé et des consommateurs de la Commission européenne, DG SANCO, a suivi l’exemple des autorités réglementaires allemandes, écartant les anomalies du développement au motif qu’elles se limitaient à des « doses toxiques pour la mère » [11], bien que la manière dont cette conclusion a été tirée ne soit pas claire.
Le raisonnement général qui sous-tend cette conclusion est que l’empoisonnement de la mère par toute substance (y compris des substances couramment ingérées comme le sel et la caféine) pourrait affecter le développement du foetus et que, par conséquent, ces malformations ne sont pas un effet direct et spécifique de la substance sur le foetus. L’Allemagne et la DG SANCO ont fait valoir que les études font état d’une toxicité maternelle et que, par conséquent, les anomalies foetales étaient dues à cette toxicité. Cependant, les études n’ont pas fait la distinction entre la toxicité maternelle et la tératogénicité spécifique au composé. Aux doses élevées utilisées, les deux phénomènes pourraient se produire.
Il est regrettable que les études standardisées menées par l’industrie à des fins réglementaires n’utilisent qu’un petit nombre d’animaux par groupe. Compte tenu de cette restriction, des doses relativement élevées du composé testé sont utilisées et les effets toxiques sur la mère sont fréquents. Ce type de conception d’étude présente un risque élevé de passer à côté des effets spécifiques au composé qui se produisent à faible et moyenne fréquence.
Une conclusion tout aussi valable qui pourrait être tirée des études industrielles est que la toxicité maternelle pourrait masquer un effet tératogène spécifique au composé et ne pas être la seule cause des malformations observées. Cela montre qu’une autre étude aurait dû être menée en utilisant des groupes d’animaux plus importants et des doses plus faibles et plus réalistes, administrées sur une période
plus longue, de préférence à vie, avant que la possibilité d’effets tératogènes spécifiques au composé puisse être éliminée et que le glyphosate puisse être considéré comme exempt d’effets tératogènes.
Paumgartten (2010) soutient cette conclusion, affirmant que dans les cas de toxicité maternelle, il n’est pas possible de savoir si un effet sur l’embryon est dû à un empoisonnement maternel non spécifique ou à une action directe du produit chimique à des doses qui ont également des effets néfastes sur la mère. Dans ce dernier cas, le produit chimique serait une toxine développementale [26].
Dallegrave et al. (2007) ont démontré que cette question est pertinente pour les formulations à base de glyphosate. Les auteurs ont examiné les effets du Roundup sur la reproduction chez les descendants mâles et femelles de rats traités pendant la grossesse et l’allaitement avec des doses de Roundup trop faibles pour induire une toxicité maternelle. Ils ont constaté que le Roundup à ces doses induisait des effets néfastes sur la reproduction chez les descendants mâles, montrant que cette formulation herbicide est une toxine reproductive à des doses non toxiques pour la mère [27].
Cela plaide en faveur de la nécessité de repenser les tests réglementaires afin d’utiliser des groupes d’animaux plus importants et des doses plus réalistes sur des périodes d’exposition plus longues, de préférence en commençant les expositions avant la naissance.
Relation dose-réponse non linéaire
Tout au long du projet de rapport d’évaluation, les régulateurs allemands ont supposé que seuls les effets suivant une relation dose-réponse linéaire étaient valables.
Mais cette hypothèse n’est pas étayée par les connaissances actuelles. Les relations dose-réponse peuvent être complexes et non linéaires, en particulier lorsque le système endocrinien est impliqué. De nombreuses preuves indiquent que pour certains composés, des effets toxiques sont observés à faibles doses, mais pas à des doses plus élevées, et que différents effets toxiques peuvent être observés à
différentes doses [28-31].
Le Roundup et le glyphosate se sont avérés être des perturbateurs endocriniens [27,32] et, par conséquent, des réponses dose-effet non linéaires peuvent s’appliquer à certains critères d’évaluation. En effet, une étude sur la neurotoxicité a non seulement révélé que le Roundup était plus toxique que le glyphosate et produisait des effets à des concentrations aussi faibles que 10 ppb ou 0,01 microgramme/L équivalent à une concentration de glyphosate de 0,5 nM), mais a également mis en évidence des relations dose-réponse « inhabituelles » avec les deux substances, suggérant que les effets à faible dose ne sont pas nécessairement prévisibles à partir des effets à forte dose [33].
Nous concluons qu’il n’est pas conforme aux connaissances scientifiques actuelles de rejeter les conclusions relatives à l’augmentation des malformations congénitales au motif d’une relation dose-réponse non linéaire. Cependant, étant donné que la pratique actuelle des organismes de réglementation suppose que la relation dose-réponse doit être linéaire, nous indiquons, le cas échéant dans le tableau 1, où une telle relation est observée.
Données de contrôle historiques
Les autorités réglementaires allemandes ont à plusieurs reprises écarté les résultats des études industrielles faisant état de malformations en se référant à des données de contrôle historiques plutôt qu’aux contrôles simultanés mesurés dans les études elles-mêmes.
Cependant, l’utilisation de cet ensemble de données de contrôle historiques est discutable à deux égards. Premièrement, le projet de rapport d’évaluation ne divulgue pas les données de contrôle historiques utilisées. Il ne fournit pas les points de données individuels ni les mesures statistiques de la variabilité au sein de l’ensemble de données. Deuxièmement, le projet de rapport d’évaluation ne présente pas de preuves démontrant la validité de cet ensemble de données de contrôle historiques.
L’utilisation de contrôles historiques plutôt que de contrôles simultanés est contraire à une méthodologie scientifique rigoureuse, qui vise à contrôler étroitement les variables. Elle introduit artificiellement des variables dans l’ensemble de données, ce qui peut masquer tout effet causé par la substance testée. Les
variables potentielles comprennent :
- la souche animale, impliquant un patrimoine génétique et une sensibilité différents.
- substance testée, introduite par différents procédés de fabrication et conditions de stockage.
- alimentation des animaux de laboratoire, dont la composition et les contaminants peuvent varier.
- agents pathogènes présents dans l’environnement.
- année et laboratoire dans lesquels les expériences ont été réalisées, pour des raisons inconnues [34].
Afin de démontrer la validité de l’utilisation de ces données de contrôle historiques pour le glyphosate, les autorités réglementaires allemandes doivent divulguer les ensembles de données utilisés et démontrer la pertinence de chaque point de données inclus dans l’ensemble de données. En l’absence d’une telle documentation, nous considérons que les conclusions du projet de rapport d’évaluation sont discutables.
Plusieurs études indiquent que les groupes témoins concomitants constituent les contrôles les plus valables et mettent en garde contre l’effet de biais lié à la réalisation de comparaisons avec des données historiques [34-36]. Cuffe (2011) a déclaré que l’utilisation de telles données peut conduire à des erreurs de type II [36].
Dans le cas du glyphosate, il s’agirait d’un faux négatif, dans lequel un résultat de toxicité aurait été négligé.
Dans de rares cas, l’utilisation de données de contrôle historiques est acceptable, par exemple lorsque les effets observés sont limites, ne montrant qu’une augmentation marginale par rapport aux contrôles simultanés, ou dans le cas de tumeurs rares, pour lesquelles aucune autre donnée que les données historiques n’est disponible. Néanmoins, il convient d’être extrêmement prudent dans la sélection des points de données inclus dans l’ensemble de données de contrôle historiques. Plus précisément, toutes les sources de variabilité dans les données de contrôle historiques doivent être identifiées et contrôlées [34]. Le projet de rapport d’évaluation ne contient aucune preuve que les autorités réglementaires allemandes aient procédé ainsi dans le cas du glyphosate.
Analyse des études financées par l’industrie à partir du projet de rapport d’évaluation
Nous analysons ci-dessous certaines études sur la tératogénicité commanditées par l’industrie et issues du projet de rapport d’évaluation des autorités réglementaires allemandes (voir le tableau 1 pour un résumé de toutes les études sur la tératogénicité commanditées par l’industrie citées dans le projet de rapport d’évaluation). Pour chaque étude analysée, nous présentons : (a) une version condensée du résumé des conclusions des autorités réglementaires allemandes ; (b) les commentaires de la Direction britannique de la sécurité des pesticides (PSD), le cas échéant ; et (c) nos commentaires.
Augmentation des malformations squelettiques, viscérales et cardiaques
En ce qui concerne l’étude menée sur des lapins par Suresh :
a. Les autorités réglementaires allemandes ont déclaré que cette étude avait révélé que le nombre total de foetus présentant des anomalies viscérales majeures était élevé dans tous les groupes traités, y compris ceux ayant reçu la faible dose de 20 mg/kg de glyphosate, et qu’il augmentait de manière significative à la dose la plus élevée de 500 mg/kg. Le pourcentage de foetus présentant une dilatation cardiaque était significativement élevé à toutes les doses. Des variations, anomalies et malformations squelettiques ont été observées, mais aucun schéma dose-réponse clair n’a été mis en évidence. Une
augmentation liée à la dose de la présence d’une 13e côte supplémentaire a été observée dans tous les groupes traités au glyphosate ; dans le groupe à forte dose, cette augmentation était statistiquement significative.
Les autorités réglementaires allemandes ont rejeté ces conclusions au motif que le nombre réel de foetus présentant une dilatation cardiaque était faible, qu’il n’y avait pas d’augmentation du nombre de foetus présentant une dilatation cardiaque dans le groupe à dose moyenne par rapport au groupe à faible dose, qu’il n’y avait pratiquement pas d’autres malformations des organes mous et que les conséquences supposées de cette malformation cardiaque étaient « équivoques ». Ils ont conclu que la faible dose de 20 mg/kg pc/j et même la dose moyenne de 100 mg/kg pc/j étaient des NOAEL (niveaux sans effet nocif observable) [37].
b. La Direction britannique de la sécurité des pesticides (PSD) a commenté : « L’augmentation de l’incidence des anomalies […] est préoccupante, en particulier les effets cardiaques qui sont également signalés dans d’autres études sur des lapins avec du glyphosate […] L’interprétation de ce résultat doit s’appuyer sur une comparaison avec les données de contrôle historiques » [38].
c. En fait, aucune NOAEL n’a été trouvée dans cette étude, car une augmentation statistiquement significative des malformations cardiaques dilatées a été observée même à la dose la plus faible de 20 mg/kg. Par conséquent, les autorités réglementaires allemandes auraient dû demander des tests supplémentaires à des doses plus faibles afin d’établir une véritable NOAEL. Leur commentaire selon lequel le nombre de foetus présentant des anomalies était faible ne fait que mettre en évidence une lacune des études standardisées menées par l’industrie à des fins réglementaires. Il est préférable d’utiliser un plus grand nombre d’animaux. Si le nombre d’animaux utilisés est faible, tout effet ne sera observé que chez quelques animaux et il sera difficile d’obtenir une signification statistique. Cela est particulièrement vrai à des doses plus faibles, où les effets observables seront plus faibles et/ou moins fréquents.
Le rejet par les autorités réglementaires allemandes des malformations cardiaques au motif qu’aucune autre malformation des organes mous n’a été constatée n’est pas valable, car les agents toxiques peuvent avoir des effets spécifiques sur certains organes. Leur argument selon lequel la malformation cardiaque par dilatation avait des conséquences « équivoques » et pouvait donc être écartée est scientifiquement et cliniquement indéfendable.
Augmentation des malformations cardiaques et des morts embryonnaires
En ce qui concerne l’étude menée sur des lapins par Brooker et al. :
a. Les autorités réglementaires allemandes ont déclaré que cette étude sur les effets du glyphosate sur la gestation chez les lapines avait révélé une augmentation significative des décès embryonnaires dans tous les groupes traités. Elles ont toutefois fait valoir que la comparaison avec les données historiques de contrôle montrait que l’incidence dans le groupe témoin concomitant était anormalement faible et que, par conséquent, l’augmentation n’était pas significative. En outre, elles ont remis en question sa signification biologique, arguant qu’aucune relation dose-réponse claire n’avait été démontrée. Les autorités réglementaires allemandes ont toutefois indiqué qu’une augmentation des morts embryonnaires tardives à la dose la plus élevée avait été signalée dans une autre étude. Ils ont noté une incidence accrue de malformations cardiaques dans le groupe à forte dose, mais ont déclaré que celle-ci se situait dans la fourchette des données historiques de contrôle. Ils ont ajouté que des anomalies cardiaques avaient été observées dans d’autres études de tératogénicité du glyphosate chez le lapin, mais ont conclu qu’un effet possible sur la survenue d’anomalies viscérales était « équivoque » [39].
b. Le PSD britannique a commenté : « L’augmentation des taux de mortalité embryonnaire/perte post-implantation à toutes les doses est préoccupante, tout comme les rapports faisant état de malformations cardiaques… un argument plus solide devrait être présenté avant que ces résultats puissent être rejetés » [38].
c. Une fois encore, les autorités réglementaires allemandes ont utilisé des données de contrôle historiques et un modèle inapproprié de relation dose-effet pour rejeter les malformations cardiaques. Nous estimons que cette conclusion n’était pas justifiée et que l’augmentation des morts embryonnaires tardives devait faire l’objet d’une enquête, car les foetus malformés font souvent l’objet d’un avortement spontané ou naissent morts. La pertinence de cette observation pour l’être humain est suggérée par une étude menée auprès de familles d’agriculteurs en Ontario, au Canada, qui a révélé un taux plus élevé que la normale de fausses couches et d’accouchements prématurés associés à l’exposition à l’herbicide à base de glyphosate [40].
Diminution du nombre de foetus viables, augmentation des malformations
En ce qui concerne une étude menée sur des lapins par Bhide et Patil :
a. Les autorités réglementaires allemandes ont déclaré que cette étude avait révélé une diminution du nombre de foetus viables par portée et une augmentation des décès embryonnaires. Le nombre de malformations viscérales et squelettiques était plus élevé dans le groupe ayant reçu la dose élevée [41].
b. Le PSD britannique a commenté : « Une autre étude présentant des preuves équivoques de malformations cardiaques » [42].
c. Une augmentation dose-dépendante des malformations pulmonaires et rénales a été observée dans tous les groupes traités. Une augmentation de la fréquence des malformations cardiaques a été observée dans tous les groupes traités. Une augmentation des malformations squelettiques (14e côte rudimentaire), typiques de l’embryopathie à l’acide rétinoïque, a été observée dans les groupes à dose moyenne et à forte dose.
Les autorités réglementaires allemandes ont déclaré à tort que la NOAEL tératogène était la dose moyenne de 250 mg/kg pc/j. En fait, les données ont montré une augmentation de la plupart des malformations, même à la dose faible de 125 mg/kg pc/j. Les auteurs de cette étude n’ont pas fourni d’analyse de la signification statistique et seuls des groupes de 15 animaux ont été utilisés, ce qui rend difficile l’obtention d’une puissance statistique à des doses plus faibles. Les données présentées dans cette étude suggèrent qu’il serait plus approprié de déclarer la dose moyenne, voire même la faible dose de 125 mg/kg comme LOAEL (dose minimale avec effet nocif observé) et d’indiquer qu’aucune NOAEL n’a été trouvée.
Augmentation des décès foetaux
En ce qui concerne une étude menée sur des rats et des lapins par Anon :
a. Les autorités réglementaires allemandes ont déclaré que cette étude sur l’alimentation orale était mal documentée et n’a été considérée que comme une information complémentaire. Aucune malformation n’a été enregistrée, mais il y a eu davantage de mortinaissances aux deux doses supérieures (50,7 et 255,3 mg/kg p.c./j.). Ils ont déclaré qu’il était difficile de comprendre pourquoi une augmentation des mortinaissances se produisait à des doses bien inférieures à celles auxquelles des effets sur les foetus avaient été observés dans les études par gavage et ont conclu qu’il était « douteux » que cet effet soit lié au traitement [43].
b. Le PSD britannique a commenté : « Bien que cette étude soit remise en question [par les autorités réglementaires allemandes] pour avoir montré des preuves de foetotoxicité à des doses plus faibles que d’autres études, l’étude de Brooker (voir ci-dessus) pourrait également indiquer une foetotoxicité à 50 mg/kg p.c./j. » [42].
c. L’hypothèse des autorités réglementaires allemandes selon laquelle les résultats obtenus à faible dose n’étaient pas liés au traitement parce que l’alimentation orale entraînait des effets différents de ceux observés lors de l’alimentation par gavage n’est pas défendable. Comme l’a souligné le PSD britannique, une autre étude a corroboré les résultats de cette étude [42].
Le projet de rapport d’évaluation ne fournit aucune explication quant à savoir si, et comment, ce désaccord a été résolu, et la question reste donc ouverte à la discussion.
Augmentation des sternèbres non ossifiées
En ce qui concerne l’étude menée sur des rats par Tasker et Rodwell :
a. Les autorités réglementaires allemandes ont déclaré que cette étude avait révélé un nombre plus élevé de foetus présentant des malformations à la dose la plus élevée (3 500 mg/kg pc/j), mais ont estimé que cela restait dans la fourchette des données de contrôle historiques et n’était pas lié au traitement. Plus précisément, il y avait davantage de foetus présentant des sternèbres non ossifiées dans le groupe à forte dose. Bien qu’ils aient admis que cet effet était lié au traitement, ils ont conclu qu’il s’agissait « plutôt d’une variation du développement que d’une malformation » [44].
b. Les autorités réglementaires allemandes ont de nouveau utilisé des données de contrôle historiques pour rejeter les preuves de tératogénicité.
Compte tenu des malformations constatées dans d’autres études, cela n’est pas justifié. Définir les sternèbres non ossifiées comme une « variation du développement » plutôt que comme une malformation est scientifiquement injustifiable. Les sternèbres non ossifiées chez le rat sont clairement définies comme une déformation squelettique dans The Handbook of Pesticide Toxicology [45].
Augmentation des malformations squelettiques
En ce qui concerne l’étude sur les rats menée par Brooker et al.
a. Les autorités réglementaires allemandes ont déclaré que cette étude par gavage chez le rat avait révélé une incidence accrue de réduction de l’ossification et de malformations squelettiques aux doses moyennes et élevées, mais ont ajouté que les résultats se situaient dans la fourchette des données de contrôle historiques. Elles ont déclaré que la toxicité maternelle était un facteur de confusion et ont qualifié la signification des malformations d’« équivoque » [46].
b. Une fois encore, les autorités réglementaires allemandes ont utilisé les données de contrôle historiques et la toxicité maternelle pour minimiser l’importance des malformations. Cependant, ces malformations concordent avec les conclusions de Paganelli et al. et sont associées à des perturbations de la voie de
signalisation de l’acide rétinoïque [1].
Conclusion du PSD
La conclusion générale du PSD britannique concernant les études sur la tératogénicité chez le lapin financées par l’industrie était la suivante : « Pris isolément, aucun des résultats […] ne serait clairement préoccupant. Cependant, dans l’ensemble, il existe une indication d’une tendance » (c’est nous qui soulignons). Le PSD a demandé aux autorités réglementaires allemandes de mettre à disposition les données de contrôle historiques auxquelles elles ont comparé les résultats de ces études [42], mais nous n’avons trouvé aucune déclaration publiée indiquant si le PSD a consulté ces données ou, le cas échéant, quelle a été sa réaction.
À la suite des délibérations des autorités réglementaires allemandes et du PSD britannique, la question de la tératogénicité liée au glyphosate a été examinée par le groupe d’experts scientifiques ECCO de la Commission européenne. Le groupe ECCO a pris note de « l’incidence des malformations cardiaques », mais les a rejetées au motif qu’elles se situaient « dans la fourchette des données de contrôle historiques » [47]. Une fois encore, la déclaration du comité ne permet pas de savoir s’il a consulté les données de contrôle historiques et, dans l’affirmative, s’il a systématiquement évalué la validité de cet ensemble de données. Par la suite, en 2002, la Commission européenne a autorisé le glyphosate.
Un niveau « sûr » trompeur fixé pour le glyphosate ?
L’objectif principal d’une évaluation des risques liés aux pesticides est d’établir une dose journalière admissible (DJA), c’est-à-dire un niveau d’exposition considéré comme sans danger pour l’homme sur une longue période. Dans le cas du glyphosate, la DJA a été calculée à partir de l’ensemble de données fournies par des études financées par l’industrie, dont certaines sont évoquées ci-dessus. Le niveau à utiliser pour fixer la DJA est la dose la plus élevée à laquelle aucun effet indésirable n’est observé (NOAEL), qui est également inférieure à la dose la plus faible à laquelle des effets indésirables sont observés (LOAEL). Ce niveau doit être sélectionné à partir de « l’étude la plus appropriée sur les espèces les plus sensibles », comme le soulignent les régulateurs allemands [48].
Les autorités réglementaires allemandes ont fixé la DJA du glyphosate à 0,3 mg/kg pc/j [49]. Cette DJA a été acceptée par la Commission européenne dans son rapport final [11].
Mais cette DJA est incorrecte. Les autorités allemandes sont parvenues à cette DJA en excluant certaines études du processus de calcul de la DJA. Tout d’abord, elles ont exclu les études de tératogénicité à moyen terme sur les lapins évoquées ci-dessus, au motif que seules les études à long terme devaient être utilisées pour fixer des niveaux d’exposition chronique sans danger. Ensuite, elles ont affirmé que l’espèce la plus sensible à l’exposition chronique était le rat [50], fournissant ainsi une autre raison d’exclure les études de tératogénicité sur les lapins.
Cependant, alors que les études à moyen terme sont généralement écartées dans les calculs de la DJA car elles sont considérées comme moins sensibles que les études à long terme, dans ce cas précis, les études à moyen terme sur les lapins ont révélé des effets toxiques à des doses plus faibles que les études à long terme sur les rats.
Par conséquent, les études à moyen terme sur les lapins se sont avérées plus sensibles, et le lapin était une espèce plus appropriée. Ces données indiquent clairement que les études sur les lapins auraient dû être utilisées pour fixer la DJA.
L’exclusion des études de toxicité chez le lapin a introduit un biais important dans les données utilisées par les autorités réglementaires allemandes pour calculer la DJA. Les autorités allemandes ont cité comme point de départ pour l’établissement de la DJA une LOAEL de 60 mg/kg p.c./j provenant d’une étude de deux ans chez le rat, qui a révélé une toxicité significative à ce niveau (Suresh et al., 1996). Il a été déclaré qu’il s’agissait de la dose la plus faible à laquelle une toxicité avait été observée. Elles ont ensuite identifié la NOAEL la plus élevée en dessous de ce niveau – 31 mg/kg p.c./j – comme celle à partir de laquelle l’ADI devait être calculée. En appliquant le facteur de sécurité habituel de 100, les autorités réglementaires allemandes ont proposé une DJA pour le glyphosate de 0,3 mg/kg pc/j [49].
Les autorités allemandes ont ignoré la LOAEL de 20 mg/kg identifiée par Suresh et al. chez les lapins, une valeur trois fois inférieure à la LOAEL de 60 mg/kg pc/j qu’elles ont choisie [51].
La raison invoquée par les autorités réglementaires allemandes pour ne pas adopter la LOAEL de 20 mg/kg (Suresh et al., 1993) pour fixer le niveau d’exposition acceptable pour les opérateurs (applicateurs) (AOEL) est qu’il s’agit d’une expérience à moyen terme plutôt qu’à long terme et qu’elle est donc plus appropriée pour fixer ce type de niveau [52].
Cependant, nous proposons que, compte tenu de la plus grande sensibilité du modèle lapin à l’exposition au glyphosate, la LOAEL de 20 mg/kg pc/j (Suresh et al., 1993) aurait dû servir de point de départ pour l’ADI et pour l’AOEL des applicateurs. En effet, cette étude n’a trouvé aucune NOAEL, car même la dose la plus faible a produit des effets toxiques [51]. Si l’on utilisait la LOAEL de 20 mg/kg, en appliquant la même procédure que les régulateurs allemands, la NOAEL la plus élevée en dessous de cette dose dans leur liste d’études approuvées serait de 10 mg/kg [49]. En appliquant le facteur de sécurité habituel de 100 à cette valeur, on obtient une DJA plus objectivement précise de 0,1 mg/kg pc/j, soit un tiers de la DJA suggérée par les autorités allemandes et adoptée par la suite par la Commission européenne.
La DJA selon des études évaluées par des pairs
Deux études toxicologiques sur les mammifères suggèrent que la LOAEL pour le glyphosate devrait être encore plus faible que la DJA de 0,1 mg/kg pc/j que nous avons dérivée des études financées par l’industrie.
Romano et al. (2010) ont découvert que le Roundup est un puissant perturbateur endocrinien et qu’il perturbe le développement reproductif des rats exposés pendant la puberté. Des effets indésirables, notamment un retard de la puberté et une réduction de la production de testostérone, ont été observés à toutes les doses, y compris à la LOAEL de 5 mg/kg. Il existait une relation dose-réponse claire [53].
Benedetti et al. (2004) ont constaté que le glyphosate-biocarb provoquait des dommages « irréversibles » aux cellules hépatiques des rats, y compris à la LOAEL de 4,87 mg/kg, avec une relation dose-réponse claire [54].
Aucune dose inférieure à ces LOAEL n’a été testée dans ces deux études [53,54], de sorte que la NOAEL sera inférieure. Hypothétiquement, si l’on supposait de manière prudente que la NOAEL était de 2,5 mg/kg pc/j, l’application d’une marge de sécurité de 100 fois donnerait une DJA de 0,025 mg/kg pc/j. Ce chiffre est douze fois inférieur à la DJA proposée par les autorités réglementaires allemandes, qui est actuellement en vigueur dans l’UE et sert de base à la limite maximale de résidus pour les denrées alimentaires et les aliments pour animaux.
Ces études ont utilisé une espèce (les rats) et une voie d’exposition (orale) qui sont acceptées par l’industrie, les régulateurs de l’UE et l’Organisation de coopération et de développement économiques (OCDE). Elles ont testé des formulations spécifiques de glyphosate, de sorte qu’on ne sait pas si leurs conclusions peuvent être extrapolées à d’autres formulations. Cela soulève toutefois une question cruciale : pourquoi les formulations sont-elles approuvées sur la base de tests industriels et d’une évaluation réglementaire portant uniquement sur l’ingrédient isolé, le glyphosate ?
Articles défendant la sécurité du glyphosate
Dans leur réfutation de l’étude de Paganelli et al., les auteurs de Monsanto/Dow/Syngenta déclarent :
Les études GLP [Good Laboratory Practice] que Paganelli et al. qualifient de « études financées par l’industrie » peu fiables ont été exhaustivement examinées par plusieurs organismes scientifiques gouvernementaux de réglementation, souvent composés d’experts scientifiques universitaires, qui ont tous fortement soutenu les conclusions présentées dans ces études. Le glyphosate ne provoque pas d’effets néfastes sur la reproduction chez les animaux adultes ni de malformations congénitales chez les descendants de ces adultes exposés au glyphosate, même à des doses très élevées [16].
Compte tenu des preuves que nous présentons ici, issues à la fois d’études universitaires et d’études financées par l’industrie, cet argument n’est pas convaincant. Les données montrent clairement que le glyphosate a des effets néfastes sur la reproduction et provoque des malformations chez les animaux de
laboratoire.
Même si l’on accepte la position proposée par Monsanto/Dow/Syngenta, selon laquelle seules les études menées conformément aux BPL doivent être prises en considération, cet argument ne résiste pas à un examen minutieux, car certaines des études figurant dans le dossier de l’industrie sur le glyphosate sont trop anciennes pour utiliser les BPL [55].
Note de la traductrice : l’article Williams et al. (2000) cité ci-dessous et utilisé par l’industrie pour tenter de montrer l’innocuité du glyphosate a été dépublié par son éditeur en décembre 2025 pour soupçons de conflits d’intérêt des auteurs, faussement présentés comme indépendants de l’industrie des fabricants de glyphosate. Voir https://www.franceinfo.fr/environnement/transition-ecologique-de-l-agriculture/pesticides/glyphosate/une-etude-affirmant-que-le-glyphosate-ne-presente-aucun-risque-grave-pour-la-sante-retiree-pour-suspicion-de-conflits-d-interets_7663813.html
Williams et al. (2000), dans un article souvent cité comme preuve de l’innocuité du Roundup et du glyphosate, invoquent également le statut GLP des études industrielles pour étayer leur affirmation selon laquelle le glyphosate n’est pas une toxine reproductive. Cependant, certaines des études qu’ils citent ne sont en fait pas conformes aux BPL : par exemple, Schroeder (1981) et Tasker (1980) [55]. De plus, ils omettent de citer d’autres études issues du même dossier industriel – Suresh (1993), Brooker (1991) et Bhide et Patil (1989) [56] – qui ont mis en évidence des effets tératogènes du glyphosate, comme détaillé ci-dessus.
Il est important de noter que les BPL ne sont pas une mesure de la fiabilité ou de la validité scientifique, mais un ensemble de règles de gestion des laboratoires instituées par les régulateurs dans les années 1970 et 1980 pour lutter contre la fraude dans les tests industriels. Il est intéressant de noter que l’adoption des normes BPL a été motivée par une affaire de fraude très médiatisée concernant des tests toxicologiques sur le glyphosate à des fins réglementaires, réalisés par un laboratoire sous contrat avec Monsanto à la fin des années 1970. Cependant, la mise en oeuvre des BPL n’a pas permis d’empêcher une deuxième affaire de fraude majeure, qui a été révélée dans les années 1990. Cette affaire concernait également le glyphosate dans un autre laboratoire sous contrat avec Monsanto, mais cette fois-ci, il s’agissait de tests de résidus [57,58]. Bien que Monsanto ait déclaré avoir par la suite remplacé les tests frauduleux [59], cette histoire montre que les tests financés par l’industrie peuvent être sujets à la fraude et que l’on ne peut pas supposer que les BPL permettent de l’empêcher.
Williams et al. (2000) et les auteurs de Monsanto/Dow/Syngenta citent tous deux des rapports de l’Organisation mondiale de la santé (OMS) pour étayer la sécurité du glyphosate [60,56,16]. Cependant, l’OMS s’appuie sur des données issues d’études industrielles [60] qui, comme indiqué ci-dessus, fournissent en fait des preuves de tératogénicité.
De plus, l’étude de Williams et al. (2000) a été co-rédigée par Ian C. Munro, dont l’affiliation était répertoriée comme étant le cabinet de conseil en industrie chimique Cantox [56]. Cantox déclare que sa mission est de « protéger les intérêts de ses clients tout en les aidant à commercialiser leurs produits » [61]. Williams et al. ont publié leur article dans la revue Regulatory Toxicology and Pharmacology, qui a fait l’objet d’une enquête par une commission du Congrès américain en 2008 en raison de son parrainage par l’industrie et de son rôle dans la décision de la FDA d’autoriser l’utilisation du bisphénol A, un perturbateur endocrinien, dans les préparations pour nourrissons et d’autres aliments [62,63].
Une étude financée par Monsanto et réalisée par Williams et al. (2012), corédigée par deux représentants du cabinet de conseil en industrie chimique Exponent, a mis en avant le manque de fiabilité de l’étude de Dallegrave (2003), en partie sur la base de l’argument selon lequel les malformations constatées étaient des artefacts de la fixation et du traitement histopathologiques [64]. Mais ces arguments hypothétiques pourraient être contredits par la relation dose-réponse claire (comme l’exigent les organismes de réglementation) mise en évidence par Dallegrave [5]. Williams et al. ont également fait valoir que les malformations n’étaient que des « signes d’un retard de développement qui se corrigent d’eux-mêmes
en peu de temps » [64]. Les auteurs n’ont fourni aucune référence à des preuves expérimentales sur lesquelles cette affirmation était fondée et n’ont pas précisé si les malformations se « corrigeaient » effectivement sans entraîner de dommages durables au système nerveux central en développement et à d’autres organes et systèmes. Cette affirmation reste donc sans fondement.
L’argument utilisé par Williams et al. (2012) est similaire à la redéfinition par les autorités allemandes d’une malformation comme une « variation du développement » [44]. En effet, dans une discussion sur une étude toxicologique non publiée sur le glyphosate chez les mammifères (IRDC, 1980a), Williams et al. ont suivi les autorités allemandes en définissant les sternèbres non ossifiées observées chez les rats traités non pas comme une malformation, mais comme « une variation, peut-être liée à la réduction du poids foetal et à un retard de développement » [64].
En ce qui concerne l’étude de Paganelli et al. [1], Williams et al. (2012) ont déclaré que la solution de glyphosate testée n’était pas ajustée en pH et que les malformations « pouvaient donc être dues à la nature acide du composé testé » [64].
Cependant, cet argument hypothétique est fallacieux, car aux dilutions utilisées, le pH de la solution tamponnée testée n’a pas été modifié par l’ajout d’herbicide.
Réponse du BVL à Dallegrave et al.
Dans sa réponse à Paganelli et al. [1], le BVL a rejeté l’étude de Dallegrave et al., qui avait mis en évidence des malformations chez les descendants de rats traités au Roundup, au motif qu’« il n’y avait pas de malformations craniofaciales » [13]. Mais il s’agit là d’une interprétation erronée de l’étude de Dallegrave, qui indiquait que « les altérations squelettiques les plus fréquentes observées étaient une ossification
incomplète du crâne et une fontanelle élargie » [5]. Ces deux anomalies sont des malformations craniofaciales. Par conséquent, contrairement à l’affirmation de la BVL, l’étude de Dallegrave et al. fournit des preuves claires qu’un herbicide à base de glyphosate peut provoquer des malformations craniofaciales.
De plus, en se concentrant sur les malformations craniofaciales, le BVL a ignoré le large éventail de malformations associées à des perturbations de la voie de signalisation de l’acide rétinoïque pendant le développement, qui ont été mises en évidence par Dallegrave et al. [5], Paganelli et al. [1] et dans les études industrielles (voir ci-dessus) à la suite d’une exposition au glyphosate. Par exemple, une malformation constatée par Dallegrave et al. dans une relation dose-dépendante était « vertèbres caudales : absentes » [5]. Cette malformation est associée à la voie de signalisation de l’acide rétinoïque. L’exposition d’embryons de souris à l’acide rétinoïque à un stade similaire de développement s’est avérée produire une agénésie des vertèbres caudales, causée par la régulation à la baisse des gènes Hox postérieurs [20].
Rapports et études provenant d’Amérique du Sud
Paganelli et al. ont déclaré avoir été incités à mener leur étude par des rapports et des études indiquant des taux élevés de malformations congénitales chez les humains dans les régions d’Amérique du Sud consacrées à la culture du soja génétiquement modifié Roundup Ready [1].
Par exemple, une étude épidémiologique menée à Itapua, au Paraguay, a révélé un taux plus élevé de malformations chez les enfants de femmes exposées à des pesticides pendant leur grossesse, par rapport au groupe témoin. Les malformations observées comprenaient des anomalies craniofaciales, des cas d’anencéphalie, de microcéphalie, d’hydrocéphalie, de myéloméningocèle, de fente palatine, d’anotie, de
polydactylie, de syndactylie et de malformations cardiaques congénitales [65].
Bon nombre de ces malformations sont du même type que celles observées par Paganelli et al. chez les grenouilles et les poulets, et sont associées à la voie de l’acide rétinoïque. Les auteurs ne mentionnent pas le glyphosate, et la plupart des applications agrochimiques utilisent des mélanges de pesticides, de sorte qu’il n’est pas possible d’identifier un seul agent causal. Cependant, Itapua est une région où la culture intensive de soja Roundup Ready est pratiquée [66].
Une étude commandée par le gouvernement provincial du Chaco, en Argentine, une région où la production de soja génétiquement modifié est intensive, a montré que les malformations congénitales avaient triplé dans la province et que les cas de cancer avaient quadruplé dans la localité agricole de La Leonesa au cours de la dernière décennie, ce qui coïncide avec l’expansion du soja génétiquement modifié et l’utilisation associée de pesticides. Les auteurs ont désigné le glyphosate comme un pesticide préoccupant et ont noté que les plaintes des habitants étaient les plus nombreuses dans les régions où des cultures génétiquement modifiées sont plantées [67].
Une étude sur les malformations congénitales dans sept régions d’Argentine a révélé que Cordoba, une zone de culture intensive de soja génétiquement modifié où les pesticides sont largement utilisés, présentait une incidence plus élevée de spina bifida, de microtie, de fente labiale avec fente palatine, de polykystose rénale, de polydactylie postaxiale et de syndrome de Down que les autres régions [68]. Bon
nombre de ces malformations sont associées à des perturbations de la voie de signalisation de l’acide rétinoïque, bien qu’il ne soit pas possible d’identifier un seul agent causal.
Études épidémiologiques en Amérique du Nord
Des études épidémiologiques menées en Amérique du Nord montrent un lien entre l’exposition aux herbicides à base de glyphosate et des effets néfastes sur la reproduction et le développement. Au Canada, l’étude Ontario Farm Family Health Study a révélé un taux plus élevé que la normale de fausses couches et d’accouchements prématurés associés à l’exposition au glyphosate [40,69]. Une étude épidémiologique menée aux États-Unis a révélé que les enfants des applicateurs de pesticides exposés aux herbicides à base de glyphosate présentaient une incidence accrue de TDAH (trouble déficitaire de l’attention avec hyperactivité) [70]. Ces résultats suggèrent que les herbicides à base de glyphosate ont un impact sur le développement neurologique.
Rull et al. ont fourni des preuves d’un lien entre l’exposition maternelle aux herbicides à base de glyphosate et l’anencéphalie, un type d’anomalie du tube neural, ainsi qu’avec les anomalies du tube neural (ATN) en général [71,72], ce qui correspond à la tératogénicité liée à l’acide rétinoïque. L’étude a révélé que l’exposition maternelle aux herbicides à base de glyphosate était associée à l’anencéphalie à l’aide d’un type de modèle analytique (modèle polytomique conventionnel à pesticides multiples), mais pas à l’aide d’un autre (modèle polytomique hiérarchique ou à pesticide unique).
Les données ont montré des associations modestes entre le glyphosate et les ATN pour les modèles à pesticide unique et à pesticides multiples, avec un rapport de cotes (RC) de 1,5 pour les deux. Pour le modèle hiérarchique, le RC était de 1,4.
Les critères des auteurs pour déterminer les effets significatifs étaient que le RC devait être supérieur ou égal à 1,4 et que la limite inférieure de l’intervalle de confiance (IC) devait être supérieure ou égale à 0,9. La condition relative au RR était remplie pour le glyphosate et les ATN dans les deux modèles, mais ceux-ci ont tous deux donné des IC de 0,8, juste en dessous de la valeur seuil [71,72].
Ces résultats indiquent une association modeste entre l’exposition à l’herbicide glyphosate et les ATN et sont en désaccord avec l’interprétation avancée par Williams et al. selon laquelle les données ne montrent « aucun effet » sur les ATN.
Williams et al. ne sont pas d’accord avec la classification du glyphosate comme organophosphate par Rull et al. [64], bien que, chimiquement, il appartienne à cette catégorie de composés.
Certaines études citées par Williams et al. (2012) dans leur revue pour défendre la sécurité des herbicides à base de glyphosate sont des études non publiées financées par l’industrie [64]. Il convient toutefois de noter que les études de tératogénicité menées par l’industrie ont porté sur le glyphosate et non sur les
formulations herbicides commerciales, qui sont les substances examinées dans les études épidémiologiques et la plupart des études de laboratoire issues de la littérature évaluée par des pairs. Il est essentiel de noter que ce sont également ces substances auxquelles les êtres humains sont exposés. Des études ont montré que, bien que le glyphosate lui-même soit toxique, les formulations sont plus toxiques que le glyphosate seul [32,33,73,74]. Même les études financées par l’industrie sur le glyphosate seul sont préoccupantes, comme indiqué ci-dessus.
Génotoxicité du glyphosate
Bien que le rapport d’évaluation de la Commission européenne de 2002 sur le glyphosate conclue qu’il n’est « pas génotoxique » [11], il est difficile de comprendre comment cette position peut être maintenue. Des études indiquent que les herbicides à base de glyphosate sont génotoxiques et peuvent donc augmenter le risque de malformations congénitales et de cancer. La surveillance cytogénétique des pulvérisateurs agricoles à Cordoba, en Argentine, a révélé que le nombre d’aberrations chromosomiques dans les cellules sanguines périphériques était significativement plus élevé dans le groupe exposé que dans le groupe non exposé.
Les pesticides les plus couramment utilisés par le groupe exposé étaient le glyphosate, la cyperméthrine et l’atrazine [75].
Une étude épidémiologique menée sur des populations équatoriennes a montré que les personnes exposées à des pulvérisations aériennes de glyphosate présentaient un degré plus élevé de dommages à l’ADN que la population témoin vivant à 80 km de distance [76]. Mañas et al. ont découvert que le glyphosate était génotoxique dans le test des comètes sur des cellules Hep-2 et dans le test du micronoyau à 400 mg/kg chez la souris [77].
Les herbicides à base de glyphosate et le principal métabolite du glyphosate, l’AMPA, ont modifié les points de contrôle du cycle cellulaire dans les embryons d’oursins en interférant avec le mécanisme de réparation de l’ADN [78-80]. On sait que la défaillance des points de contrôle du cycle cellulaire entraîne une instabilité génomique et un cancer chez l’homme. Il a également été démontré que le glyphosate et l’AMPA causaient des dommages irréversibles à l’ADN, ce qui peut augmenter le risque de cancer [77,81]. L’AMPA a endommagé l’ADN des cellules humaines à des doses de 2,5 à 7,5 mM et a provoqué des cassures chromosomiques à 1,8 mM [81].
Les tensioactifs et autres adjuvants présents dans les formulations de glyphosate renforcent les effets toxiques de ce dernier, car ils lui permettent de pénétrer plus facilement à travers la membrane cellulaire [79,82]. Les adjuvants sont également toxiques en eux-mêmes [73].
Étude sur l’exposition des familles d’agriculteurs
Les auteurs de Monsanto/Dow/Syngenta ont cité l’étude Farm Family Exposure Study (FFES) [83] comme preuve que les doses utilisées par Paganelli et al. et la suggestion d’un lien entre l’exposition à l’herbicide glyphosate et les malformations congénitales en Argentine sont irréalistes [16]. La FFES a mesuré les concentrations urinaires de glyphosate chez les agriculteurs, leurs conjoints et leurs enfants. L’étude a conclu que la dose systémique maximale chez les conjoints dans la FFES n’était que de 0,04 μg/kg de poids corporel, plus de 95 % des expositions des conjoints étant inférieures à la limite de détection [83]. Les auteurs de Monsanto/Dow/Syngenta ont déclaré que ce scénario d’exposition était « similaire » à celui des populations d’Argentine et d’autres régions productrices de soja d’Amérique du Sud qui faisaient l’objet de préoccupations dans l’étude de Paganelli et al. [16].
Cependant, il est difficile d’imaginer en quoi ces deux scénarios sont similaires. Le FFES, basé aux États-Unis, a mesuré les concentrations de glyphosate dans l’urine la veille, le jour même et les trois jours suivant une seule application de glyphosate, effectuée à l’aide d’un tracteur et d’un pulvérisateur à rampe. Aux États-Unis, il est courant que les agriculteurs pulvérisent depuis l’environnement relativement protégé d’une cabine climatisée fermée. Les personnes vivant dans les régions sudaméricaines productrices de soja génétiquement modifié sont exposées non pas une seule fois, mais fréquemment pendant la saison de croissance, et l’application est souvent effectuée par voie aérienne, ce qui entraîne des problèmes de dérive.
De plus, toute évaluation des effets de l’exposition aux pesticides doit tenir compte des effets d’une exposition répétée et continue. Bolognesi (2003) a constaté que les dommages chromosomiques causés par les pesticides étaient temporaires en cas d’exposition courte ou limitée dans le temps, mais cumulatifs en cas d’exposition continue aux produits agrochimiques [84].
Les auteurs de la FFES ont reconnu que la nature de leur étude avait pu inciter les agriculteurs participants à redoubler de prudence dans leur travail. Par conséquent, elle ne reflète peut-être pas les conditions réelles, même aux États-Unis (un représentant de l’étude était présent avec l’agriculteur au moment de l’application). De plus, la FFES a été parrainée par des membres de l’industrie des pesticides : Bayer, Dow, DuPont, FMC, Monsanto, Syngenta et l’American Chemistry Council. L’un des auteurs, Acquavella, était employé par Monsanto ; un autre était employé par le cabinet de conseil industriel Exponent. Ces liens avec l’industrie des pesticides créent un risque de partialité.
Pour ces raisons, le FFES pourrait ne pas refléter des conditions réalistes. Mage (2006) a déclaré dans une critique du FFES qu’une étude évaluant de manière aléatoire et fréquente les charges de glyphosate dans les familles d’agriculteurs sur une longue période permettrait d’obtenir une évaluation plus réaliste de l’exposition [85].
Nos préoccupations sont corroborées par une autre étude, qui n’est pas mentionnée par les auteurs de la réfutation de Monsanto/Dow/Syngenta. Dans une étude portant sur l’exposition aux pesticides dans des familles d’agriculteurs et de non-agriculteurs dans l’Iowa, aux États-Unis, Curwin et al. (2007) ont constaté que 75 % des agriculteurs, 67 % des épouses et 81 % des enfants d’agriculteurs présentaient une charge urinaire supérieure à 900 ppb de glyphosate (0,9 mg/kg pc) [86]. En revanche, la FFES a rapporté des charges urinaires moyennes de glyphosate comprises entre 1 et 6,4 ppb à différents jours de l’étude pour les agriculteurs, et des moyennes proches de 0 ppb pour les épouses et les enfants (moins de 25 % des sujets présentaient une charge urinaire détectable de glyphosate) [83].
Affaires judiciaires relatives à l’exposition à l’herbicide glyphosate
La sécurité des herbicides à base de glyphosate a été remise en cause avec succès dans plusieurs affaires judiciaires. À New York, en 1996, un tribunal a décidé que Monsanto n’était plus autorisé à commercialiser le Roundup en le présentant comme un produit sûr, non toxique, biodégradable ou respectueux de l’environnement [87]. En France, en 2007, Monsanto a été contraint de retirer ses publicités affirmant que le Roundup était biodégradable et qu’il ne laissait aucune trace dans le sol après utilisation [88]. En mars 2010, dans une affaire portée devant les tribunaux par des habitants, un tribunal de la province de Santa Fe, en Argentine, a instauré une interdiction régionale de pulvérisation de glyphosate et d’autres produits agrochimiques dans les zones peuplées, au motif de « dommages graves à l’environnement, à la santé et à la qualité de vie des habitants » [89].
En juin 2012, des poursuites pénales ont été engagées par des habitants concernés contre deux producteurs de soja et un pilote d’avion pulvérisateur, dans une affaire jugée par un tribunal de Cordoba, en Argentine. Les plaignants ont accusé les défendeurs de contamination malveillante pour avoir pulvérisé du glyphosate et d’autres produits agrochimiques à Ituzaingó, une zone située à la périphérie de Cordoba qui serait caractérisée par une incidence élevée de cancers et de malformations congénitales [90].
Pertinence des différentes voies d’exposition
Le BVL et Monsanto/Dow/Syngenta ont rejeté l’étude de Paganelli et al. au motif qu’elle utilisait des voies d’exposition inappropriées. Ils s’opposent à l’injection et à la culture au motif qu’elles sont « hautement artificielles », « ne reflètent pas l’exposition humaine » [13] et sont « non pertinentes » [16] pour l’évaluation des risques pour l’homme. Cet argument est également utilisé par Williams et al. (2012)
pour défendre la sécurité du glyphosate [64].
La norme invoquée n’est pas nommée, mais il s’agit probablement des protocoles normalisés de l’OCDE pour les études industrielles réalisées à des fins réglementaires, qui privilégient les voies d’exposition orale, cutanée ou par inhalation [91].
Les lignes directrices de l’OCDE ont pour but de guider l’industrie dans la conduite de tests normalisés réalisés à des fins réglementaires, mais il n’est pas crédible de suggérer qu’elles représentent la seule voie valable ou la plus rigoureuse scientifiquement pour obtenir des informations sur la toxicité d’un produit chimique.
Dans le cas de l’étude de Paganelli et al. [1], l’injection de glyphosate au groupe traité et d’eau au groupe témoin a permis de clarifier que seule une substance, le glyphosate, pouvait avoir causé les malformations. L’absence de malformations chez les témoins ayant reçu une injection d’eau a montré que le traumatisme de l’injection n’était pas à l’origine des malformations.
Deux études comparant l’administration orale à l’injection ont présenté des résultats qui remettent en question les hypothèses concernant les différentes voies d’exposition :
- Une étude comparant les effets du bisphénol A (BPA) administré à des rats par voie orale et par injection a révélé qu’après deux heures, le niveau de BPA actif dans le sang était le même entre les groupes ayant reçu une dose par voie orale et ceux ayant reçu une injection. Les deux voies d’exposition ont entraîné les mêmes effets toxiques précancéreux sur la prostate sept mois après l’exposition. L’étude a conclu que la dose interne reçue, et non la voie d’exposition, est le facteur critique, et que par conséquent, la voie d’exposition par injection devrait être acceptable pour l’évaluation des risques chez l’homme [92,93].
- Une étude comparant la toxicocinétique du glyphosate administré à des rats par voie orale et par injection a révélé que, lorsqu’il était administré par voie orale, le glyphosate était absorbé plus lentement, mais mettait plus de temps à être éliminé du sang, ce qui pouvait entraîner sa distribution dans les tissus et provoquer des effets toxiques systémiques [94]. La voie orale est privilégiée par l’industrie et les organismes de réglementation au motif qu’elle reflète mieux l’exposition réelle chez l’homme. Ainsi, sur la base de cette étude, on peut supposer que les expériences utilisant l’injection entraînent moins d’effets toxiques que celles utilisant des méthodes orales.
Bien que les doses reçues par différents tissus puissent varier en fonction de la voie d’exposition, cela doit être testé et non supposé. Il semble essentiel de mener des études de biosurveillance sur les populations exposées afin de déterminer la quantité de glyphosate et de son principal métabolite, l’AMPA, présente dans les tissus et d’étudier le potentiel de bioaccumulation.
Une étude in vitro sur des cellules buccales humaines a tenté de reproduire l’exposition humaine à l’herbicide glyphosate par inhalation. L’étude a révélé que le glyphosate et le Roundup causaient des dommages à l’ADN des cellules après une seule exposition de 20 minutes à une dose correspondant à une dilution 450 fois supérieure à la concentration utilisée en agriculture. Le Roundup s’est révélé plus toxique que le glyphosate seul. Les auteurs ont conclu que l’inhalation pouvait causer des dommages à l’ADN chez les personnes exposées et que ces dommages étaient causés directement par les substances plutôt que d’être le résultat indirect de la toxicité cellulaire [95].
Alors que les auteurs de Monsanto/Dow/Syngenta condamnent les méthodes in vitro comme étant « non validées », ce jugement de valeur soulève seulement la question suivante : validées par qui ? Nous interprétons cette déclaration comme signifiant que ces tests in vitro ne sont pas conformes aux protocoles normalisés de l’OCDE pour les études toxicologiques industrielles. Cependant, en dehors du contexte restreint des tests industriels à des fins réglementaires, ces tests in vitro constituent un outil important. Par exemple, dans la phase préclinique du développement d’un médicament pharmaceutique, si un médicament potentiel donne un résultat positif au test du micronoyau in vitro, le développement est interrompu. De plus, ces tests in vitro apportent des preuves précieuses aux résultats des études épidémiologiques in vivo et humaines en laboratoire. En ce qui concerne le glyphosate et le Roundup, toutes ces études suggèrent que ces deux substances sont génotoxiques et ont des effets toxiques sur le développement et la reproduction.
Des doses irréalistes ?
Dans leur réponse à Paganelli et al., les auteurs de Monsanto/Dow/Syngenta affirment que les chercheurs ont utilisé des doses « inappropriées » et « irréalistes », bien supérieures aux doses déjà élevées qui, selon d’autres études, ne provoquent pas de malformations [16].
Si l’on considère tout d’abord les expériences d’injection sur des embryons de grenouilles menées par Paganelli et al., les calculs basés sur l’article de Monsanto/Dow/Syngenta montrent que les doses n’étaient pas excessivement élevées. Les auteurs de Monsanto/Dow/Syngenta ont déclaré qu’une dose de 400 mg/kg de glyphosate, administrée par voie alimentaire, entraîne une concentration sanguine de 4,6 μg/ml. Les études sur les animaux utilisent généralement des doses comprises entre 50 et 500 mg/kg pc/j. En effectuant une extrapolation linéaire (comme le font les auteurs de Monsanto/Dow à d’autres fins), une dose de 50 mg/kg devrait entraîner une concentration sanguine de 0,575 μg/ml, soit 575 μg/L. Par conséquent, la fourchette des concentrations sanguines obtenues dans les études animales serait comprise entre 575 et 5750 μg/L. Il est clair que les concentrations obtenues dans les embryons de grenouille (690-950 μg/L) sont comparables aux concentrations sanguines généralement obtenues dans les études d’alimentation animale.
En ce qui concerne les expériences de culture d’embryons de grenouilles menées par Paganelli et al., les auteurs de Monsanto/Dow/Syngenta ont déclaré que les concentrations utilisées étaient 9 à 15 fois supérieures à la valeur LC50 aiguë pour les embryons de grenouilles de la même espèce. Monsanto/Dow cite comme référence pour cet argument une étude réalisée par Edginton et al. [96]. Cependant, Edginton a utilisé une formulation différente du glyphosate, avec une valeur CL50 potentiellement différente. De plus, le faible taux de mortalité constaté par Paganelli et al. contredit l’affirmation des auteurs de Monsanto/Dow/Syngenta selon laquelle les doses utilisées étaient proches de la valeur CL50.
En ce qui concerne les expériences de Paganelli et al.sur des oeufs de poule, en utilisant l’estimation des auteurs de Monsanto/Dow/Syngenta selon laquelle 20 μL d’une dilution au 1/4500 d’un produit à base de glyphosate correspondent à 2 μg de glyphosate injectés dans l’oeuf, et en supposant que le volume d’un oeuf de poule est d’environ 35 ml, la concentration réelle de glyphosate dans l’oeuf serait de 57 μg/L. Ce chiffre est bien inférieur aux concentrations sanguines de glyphosate attendues dans les études de toxicité animale (575-5750 μg/L, voir ci-dessus), selon les méthodes de calcul de Monsanto/Dow.
Une nouvelle donnée, encore non publiée, obtenue par les mêmes chercheurs, contredit également l’affirmation selon laquelle Paganelli et al. auraient utilisé des doses irréalistes ou supérieures à la valeur CL50. Dans ces expériences de culture avec des embryons de Xenopus laevis, la même méthodologie a été suivie que dans les expériences de culture originales détaillées dans Paganelli et al. [1] Une formulation commerciale différente du Roundup a été utilisée (Gleba de Gleba S.A., au lieu du Roundup Classic utilisé dans les expériences originales) et des lots d’embryons ont été cultivés dans des dilutions progressivement plus faibles. Les mêmes malformations que celles observées dans les expériences originales ont été reproduites de manière dose-dépendante, même à des dilutions de 1/500 000 (4,30 μM). Cette dilution a produit des anomalies du développement chez 17 % des embryons, sans létalité [97].
Conclusion
Des études publiées dans la littérature scientifique évaluée par des pairs ont soulevé de sérieuses préoccupations quant au potentiel du glyphosate et de ses formulations commerciales de glyphosate de provoquer des malformations congénitales et d’autres problèmes de reproduction. En outre, un débat a émergé sur les effets signalés sur la santé humaine de l’application d’herbicides dans les régions qui produisent des cultures génétiquement modifiées tolérantes au glyphosate et sur la sécurité des denrées alimentaires et des aliments pour animaux produits à partir de ces cultures.
Les autorités réglementaires et les affiliés de l’industrie ont défendu l’utilisation du glyphosate en citant principalement les tests toxicologiques commandités par l’industrie et réalisés à des fins réglementaires, qui, selon eux, ne montraient aucune preuve de tératogénicité. Cependant, le projet de rapport d’évaluation des autorités allemandes a révélé que même ces tests industriels contenaient des preuves claires de tératogénicité et de toxicité reproductive liées au glyphosate. Bon nombre des malformations observées dans ces études sont du type associé à la voie de signalisation de l’acide rétinoïque. Paganelli et al. [1] ont montré que c’était le mécanisme par lequel le glyphosate et le Roundup exerçaient leurs effets tératogènes.
Il convient de noter que ces tests industriels ont été commandés par les mêmes entreprises qui ont tout à gagner de l’autorisation réglementaire. Malheureusement, ce système comporte un risque inhérent de partialité, ce qui rend d’autant plus importante la rigueur de l’évaluation réglementaire. Or, dans l’Union européenne, les éléments disponibles suggèrent que cela n’a pas été le cas. L’importance des effets tératogènes évidents du glyphosate chez les lapins et les rats, mis en évidence dans les tests commandés par l’industrie, a été minimisée par les autorités réglementaires allemandes. Une évaluation scientifiquement rigoureuse a été encore entravée par la conception obsolète des tests standard, qui ne sont pas suffisamment sensibles pour détecter les effets d’une exposition réaliste. En conséquence, les autorités allemandes ont proposé, et l’UE a adopté, une dose journalière admissible (DJA) pour le glyphosate qui n’est pas fiable et pourrait potentiellement entraîner des expositions nocives pour l’homme.
Un autre facteur pertinent est que les tests de tératogénicité réalisés par l’industrie portaient sur le glyphosate, l’ingrédient actif présumé de l’herbicide, et non sur les formulations herbicides telles qu’elles sont vendues et utilisées, alors que des études indiquent que les formulations sont plus toxiques que le glyphosate seul pour certains critères d’évaluation.
De nombreuses preuves démontrent que le glyphosate et le Roundup ont des effets tératogènes et d’autres effets toxiques sur la reproduction, ainsi que des effets génotoxiques. D’un point de vue scientifique objectif, les tentatives de l’industrie et des organismes de réglementation gouvernementaux visant à rejeter ces recherches ne sont pas convaincantes et vont à l’encontre du principe selon lequel il incombe à l’industrie de prouver que ses produits sont sûrs et non au public de prouver qu’ils sont dangereux. Le principe de précaution suggère que le glyphosate et ses formulations commerciales devraient faire l’objet d’une nouvelle évaluation des risques, tenant pleinement compte de l’ensemble de la littérature scientifique évaluée par des pairs ainsi que des études financées par l’industrie. L’expérience acquise à ce jour suggère que la nouvelle évaluation des risques devrait être menée en toute transparence publique par des scientifiques indépendants de l’industrie.
Avertissement
Les opinions exprimées sont celles des auteurs individuels et ne reflètent pas les politiques des organisations auxquelles ils sont associés.
Références
- Paganelli A, Gnazzo V, Acosta H, López SL, Carrasco AE (2010) Glyphosatebased
herbicides produce teratogenic effects on vertebrates by impairing
retinoic acid signaling. Chem Res Toxicol 23: 1586-1595. - Jayawardena UA, Rajakaruna RS, Navaratne AN, Amerasinghe PH (2010)
Toxicity of agrochemicals to common hourglass tree frog (Polypedates
cruciger) in acute and chronic exposure. Int J Agric Biol 12: 641–648. - Relyea RA (2012) New effects of Roundup on amphibians: Predators reduce
herbicide mortality; herbicides induce antipredator morphology. Ecological
Applications 22: 634-647. - Lajmanovich RC, Sandoval MT, Peltzer PM (2003) Induction of mortality and
malformation in Scinax nasicus tadpoles exposed to glyphosate formulations.
Bull Environ Contam Toxicol 70: 612-618. - Dallegrave E, Mantese FD, Coelho RS, Pereira JD, Dalsenter PR, et al. (2003)
The teratogenic potential of the herbicide glyphosate-Roundup in Wistar rats.
Toxicol Lett 142: 45-52. - GMO Compass (2012) Soybeans. Genius GmBH.
- Bindraban PS, Franke AC, Ferrar DO, Ghersa CM, Lotz LAP, et al. (2009) GMrelated
sustainability: Agro-ecological impacts, risks and opportunities of soy
production in Argentina and Brazil. Plant Research International, Wageningen,
The Netherlands. - Branford S (2004) Argentina’s bitter harvest. New Scientist, 17 April.
- Mesnage R, Clair E, Gress S, Then C, Székács A, et al. (2012) Cytotoxicity
on human cells of Cry1Ab and Cry1Ac Bt insecticidal toxins alone or with a
glyphosate-based herbicide. J Appl Toxicol 15. - Food and Agriculture Organization (FAO) (2005) Pesticide residues in food-
2005: Evaluations Part I: Residues (S. 477). - European Commission Health & Consumer Protection Directorate-General
(2002) Review report for the active substance glyphosate. - Antoniou M, Habib M, Howard CV, Jennings RC, Leifert C, et al. (2011)
Roundup and birth defects: Is the public being kept in the dark? Earth Open
Source. 1-52. - Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVL) (2010)
Glyphosate – Comments from Germany on the paper by Paganelli, A. et al.:
“Glyphosate-based herbicides produce teratogenic effects on vertebrates by
impairing retinoic acid signaling”. Braunschweig, Germany. - Dalli J (2011) Answer given by Mr Dalli on behalf of the Commission,
Parliamentary questions, European Parliament, Brussels. 10. - European Commission (2010) Directive 2010/77/EU of 10 November
2010 amending Council Directive 91/414/EEC as regards the expiry dates
for inclusion in Annex I of certain active substances. Official Journal of the
European Union. - Saltmiras D, Bus JS, Spanogle T, Hauswirth J, Tobia A, et al. (2011) Letter
to the editor regarding the article by Paganelli et al. Chem Res Toxicol 24:
607-608. - Carrasco AE (2011) Reply to the letter to the editor regarding our article
(Paganelli et al., 2010). Chem Res Toxicol 24: 610-613. - European Commission (1998) Glyphosate. Reasoned statement of the overall
conclusions drawn by the rapporteur member state, in: Rapporteur member
state, Germany (1998) Monograph on Glyphosate, 1: 9. - Lammer EJ, Chen DT, Hoar RM, Agnish ND, Benke PJ, et al. (1985) Retinoic
acid embryopathy. N Engl J Med 313: 837-841. - Kessel M (1992) Respecification of vertebral identities by retinoic acid.
Development 115: 487-501. - Huang FJ, Wu TC, Tsai MY (2001) Effect of retinoic acid on implantation and
post-implantation development of mouse embryos in vitro. Hum Reprod 16:
2171-2176. - Malpel S, Mendelsohn C, Cardoso WV (2000) Regulation of retinoic acid
signaling during lung morphogenesis. Development 127: 3057-3067. - Wilson JG, Roth CB, Warkany J (1953). An analysis of the syndrome of
malformation induced by maternal vitamin A deficiency: Effects of restoration of
vitamin A at various times during gestation. Am. J. Anat. 92: 189-217. - Shenefelt RE (1972) Morphogenesis of malformations in hamsters caused by
retinoic acid: relation to dose and stage at treatment. Teratology 5: 103-118. - Dickman ED, Thaller C, Smith SM (1997). Temporally-regulated retinoic acid
depletion produces specific neural crest, ocular and nervous system defects.
Development 124: 3111-3121. - Paumgartten FJ (2010) Influence of maternal toxicity on the outcome of
developmental toxicity studies. J Toxicol Environ Health A 73: 944-951. - Dallegrave E, Mantese FD, Oliveira RT, Andrade AJ, Dalsenter PR, et al.
(2007) Pre- and postnatal toxicity of the commercial glyphosate formulation in
Wistar rats. Arch Toxicol 81: 665-673. - Welshons WV, Thayer KA, Judy BM, Taylor JA, Curran EM, et al. (2003)
Large effects from small exposures. I. Mechanisms for endocrine-disrupting
chemicals with estrogenic activity. Environ Health Perspect 111: 994-1006. - Vandenberg LN, Colborn T, Hayes TB, Heindel JJ, Jacobs DR Jr et al.
(2012) Hormones and endocrine-disrupting chemicals: Low-dose effects and
nonmonotonic dose responses. Endocr Rev 33: 378-455. - Goldsmith JR, Kordysh E (1993) Why dose-response relationships are often
non-linear and some consequences. J Expo Anal Environ Epidemiol 3: 259-
276. - Vom Saal FS, Hughes C (2005) An extensive new literature concerning lowdose
effects of bisphenol A shows the need for a new risk assessment. Environ
Health Perspect 113: 926-933. - Richard S, Moslemi S, Sipahutar H, Benachour N, Seralini GE (2005)
Differential effects of glyphosate and roundup on human placental cells and
aromatase. Environ Health Perspect 113: 716-720. - Axelrad JC, Howard CV, McLean WG (2003) The effects of acute pesticide
exposure on neuroblastoma cells chronically exposed to diazinon. Toxicology
185: 67-78. - Haseman JK (1984) Statistical issues in the design, analysis and interpretation
of animal carcinogenicity studies. Environ Health Perspect 58: 385-392. - Hardisty JF (1985) Factors influencing laboratory animal spontaneous tumor
profiles. Toxicol Pathol 13: 95-104. - Cuffe RL. The inclusion of historical control data may reduce the power of a
confirmatory study. Stat Med 30: 1329-1338. - Rapporteur member state, Germany (1998) Monograph on Glyphosate. Annex
B-5: Toxicology and Metabolism: Volume 3-1, Glyphosat 5: 15-17. - EU Commission (1999) Glyphosate: Comments from Pesticides Safety
Directorate, UK, on EC Monographs for Glyphosate and Glyphosate Trimesium:
Glyphosat 5: 25. - Rapporteur member state, Germany (1998) Monograph on Glyphosate. Annex
B-5: Toxicology and Metabolism: Volume 3-1, Glyphosat 5: 18. - Savitz DA, Arbuckle T, Kaczor D, Curtis KM (1997) Male pesticide exposure
and pregnancy outcome. Am J Epidemiol 146: 1025-1036. - Rapporteur member state, Germany (1998) Monograph on Glyphosate. Annex
B-5: Toxicology and Metabolism: Volume 3-1, Glyphosat 5: 19. - EU Commission (1999) Glyphosate: Comments from Pesticides Safety
Directorate, UK, on EC Monographs for Glyphosate and Glyphosate Trimesium:
Glyphosat 5: 26. - Rapporteur member state, Germany (1998) Monograph on Glyphosate. Annex
B-5: Toxicology and Metabolism: Volume 3-1, Glyphosat 5: 19, 10. - Rapporteur member state, Germany (1998) Monograph on Glyphosate. Annex
B-5: Toxicology and Metabolism: Volume 3-1, Glyphosat 5: 13. - Krieger RI (2001) Handbook of Pesticide Toxicology, Vol. I: Principles.
Academic Press, San Diego, CA, p. 1185. - Rapporteur member state, Germany (1998) Monograph on Glyphosate. Annex
B–5: Toxicology and Metabolism: Volume 3-1, Glyphosat 5: 12. - EU Commission ECCO Panel (1999) Discussion ECCO Peer Review Meeting:
Glyphosate( Hb), Appendix 1, Glyphosat 3: 30. - Rapporteur member state, Germany (1998) Monograph on Glyphosate. Annex
B–5: Toxicology and Metabolism: Volume 3-1, Glyphosat 5: 41. - Rapporteur member state, Germany (1998) Monograph on Glyphosate. Annex
B–5: Toxicology and Metabolism: Volume 3-1, Glyphosat 5: 43. - Rapporteur member state, Germany (1998) Monograph on Glyphosate. Annex
B–5: Toxicology and Metabolism: Volume 3-1, Glyphosat 5: 42. - Rapporteur member state, Germany (1998) Monograph on Glyphosate. Annex
B–5: Toxicology and Metabolism: Volume 3-1, Glyphosat 5: 15-17, 42-44. - Rapporteur member state, Germany (1998) Monograph on Glyphosate. Annex
B–5: Toxicology and Metabolism: Volume 3-1, Glyphosat 5: 44. - Romano RM, Romano MA, Bernardi MM, Furtado PV, Oliveira CA (2010)
Prepubertal exposure to commercial formulation of the herbicide Glyphosate
alters testosterone levels and testicular morphology. Arch Toxicol 84: 309-317. - Benedetti AL, Vituri C de L, Trentin AG, Domingues MA, Alvarez-Silva M (2004)
The effects of sub-chronic exposure of Wistar rats to the herbicide Glyphosate-
Biocarb. Toxicol Lett 153: 227-232. - The non-GLP status of these studies is shown in: Rapporteur member state,
Germany (1998) Monograph on Glyphosate. List of Tests and Studies. - ETUDE RETIREE PAR L’EDITEUR Williams GM, Kroes R, Munro IC (2000) Safety evaluation and risk assessment of the herbicide Roundup and its active ingredient, glyphosate, for humans.
Regul Toxicol Pharmacol 31: 117-165. - Cox C (1998) Glyphosate (Roundup). J Pesticide Ref 18: 3-17.
- Novak RA (2001) The long arm of the lab laws. Today’s Chemist at Work 10:
45-46. - Monsanto (2005). Backgrounder: Testing fraud: IBT and Craven Labs.
- World Health Organization and Food and Agriculture Organization (2004)
Pesticide residues in food – 2004. Report of the Joint Meeting of the FAO Panel
of Experts on Pesticide Residues in Food and the Environment and the WHO
Core Assessment Group on Pesticide Residues. FAO Plant Production and
Protection Paper 178: 98-103. - Cantox (2012) Cantox Health Sciences International.
- Layton L (2008) Studies on chemical in plastics questioned. Washington Post.
- Dingell JD, Rep. (D-Mich.) (2008) Letter to Jack N. Gerard, president and CEO,
American Chemistry Council. - Williams AL, Watson RE, DeSesso JM (2012) Developmental and reproductive
outcomes in humans and animals after glyphosate exposure: A critical analysis.
J Toxicol Environ Health B Crit Rev 15: 39-96. - Benítez-Leite S, Macchi ML, Acosta M (2009) Malformaciones congénitas
asociadas a agrotóxicos [Congenital malformations associated with toxic
agricultural chemicals]. Arch Pediatr Urug 80: 237-247. - Gray L (2011) GM soy: the high cost of the quest for “green gold”. The
Telegraph (UK). - Provincial Research Commission Water Pollutants, First Report [First report],
Resistencia, Chaco, Argentina (2010). - Campana H, Pawluk MS, Lopez Camelo JS (2010) [Births prevalence of 27
selected congenital anomalies in 7 geographic regions of Argentina]. Archivos
Argentinos de Pediatria 108: 409-417. - Arbuckle TE, Lin Z, Mery LS (2001) An exploratory analysis of the effect of
pesticide exposure on the risk of spontaneous abortion in an Ontario farm
population. Environmental Health Perspectives 109: 851-857. - Garry VF, Harkins ME, Erickson LL, Long-Simpson LK, Holland SE, et al.
(2002) Birth defects, season of conception, and sex of children born to pesticide
applicators living in the Red River Valley of Minnesota, USA. Environ Health
Perspect 110: 441-449. - Rull RP, Ritz B, Shaw GM (2004) Neural tube defects and maternal residential
proximity to agricultural pesticide applications. Epidemiology 15: S188. - Rull RP, Ritz B, Shaw GM (2006) Neural tube defects and maternal residential
proximity to agricultural pesticide applications. Am J Epidemiol 163: 743-753. - Benachour N, Séralini GE (2009) Glyphosate formulations induce apoptosis
and necrosis in human umbilical, embryonic, and placental cells. Chem Res
Toxicol 22: 97-105. - Dallegrave E, Mantese FD, Dalsenter PR, Langeloh A (2002) Acute oral toxicity
of glyphosate in Wistar rats. Online J Vet Res 1: 29-36. - Mañas F, Peralta L, Gorla N, Bosh B, Aiassa D (2009) Chromosomal
aberrations in workers occupationally exposed to pesticides in Córdoba. J
Basic Appl Genet 20: 9-13. - Paz-y-Miño C, Sánchez ME, Arévalo M, Muñoz, MJ, Witte T, et al. (2007)
Evaluation of DNA damage in an Ecuadorian population exposed to glyphosate.
Genetics and Molecular Biology 30: 456-460. - Mañas F, Peralta L, Raviolo J, Ovando HG, Weyers A, et al. (2009) Genotoxicity
of glyphosate assessed by the Comet assay and cytogenic tests. Environ
Toxicol Pharmacol 28: 37-41. - Marc J, Mulner-Lorillon O, Belle R (2004) Glyphosate-based pesticides affect
cell cycle regulation. Biol Cell 96: 245-249. - Marc J, Mulner-Lorillon O, Boulben S, Hureau D, Durand G, et al. (2002)
Pesticide Roundup provokes cell division dysfunction at the level of CDK1/
Cyclin B activation. Chem Res Toxicol 15: 326-331. - Marc J, Belle R, Morales J, Cormier P, Mulner-Lorillon O (2004) Formulated
glyphosate activates the DNA-response checkpoint of the cell cycle leading to
the prevention of G2/M transition. Toxicol Sci 82: 436-442. - Mañas F, Peralta L, Raviolo J, García Ovando H, Weyers A, et al. (2009)
Genotoxicity of AMPA, the environmental metabolite of glyphosate, assessed
by the Comet assay and cytogenetic tests. Ecotoxicol Environ Saf Mar 72: 834-
837. - Haefs R, Schmitz-Eiberger M, Mainx HG, Mittelstaedt W, Noga G (2002)
Studies on a new group of biodegradable surfactants for glyphosate. Pest
Manag Sci 58: 825-833. - Acquavella JF, Alexander BH, Mandel JS, Gustin C, Baker B, et al. (2004)
Glyphosate biomonitoring for farmers and their families: Results from the Farm
Family Exposure Study. Environ Health Perspect 112: 321-326. - Bolognesi C (2003) Genotoxicity of pesticides: a review of human biomonitoring
studies. Mutat Res 543: 251-272. - Mage DT (2006) Suggested corrections to the Farm Family Exposure Study.
Environ Health Perspect 114: A633. - Curwin BD, Hein MJ, Sanderson WT, Striley C, Heederik D, et al. (2007)
Urinary pesticide concentrations among children, mothers and fathers living in
farm and non-farm households in Iowa. Ann Occup Hyg 51: 53-65. - Attorney General of the State of New York, Consumer Frauds and Protection
Bureau, Environmental Protection Bureau (1996) In the matter of Monsanto
Company, respondent. Assurance of discontinuance pursuant to executive law
§ 63(15). New York, Nov. False advertising by Monsanto regarding the safety
of Roundup herbicide (glyphosate). - Agence France Presse (2007) Monsanto fined in France for “false” herbicide
ads. Organic Consumers Association. - Romig S (2010) Argentina court blocks agrochemical spraying near rural town.
Dow Jones Newswires. 17 March. - Magnani, R. (2012) Niños con malformaciones de nacimiento [Children with
birth defects]. Pagina 12. - Organisation for Economic Cooperation and Development (OECD) (2009)
OECD guideline for the testing of chemicals: Chronic toxicity studies. Adopted. - Prins GS, Ye SH, Birch L, Ho SM, Kannan K (2011) Serum bisphenol A
pharmacokinetics and prostate neoplastic responses following oral and
subcutaneous exposures in neonatal Sprague-Dawley rats. Reprod Toxicol 31:
1-9. - Mackar R (2010) New BPA findings help fill research gaps. Environmental
Factor, NIEHS, October. - Anadón A, Martinez-Larranaga MR, Martinez MA, Castellano VJ, Martinez
M, et al. (2009) Toxicokinetics of glyphosate and its metabolite aminomethyl
phosphonic acid in rats. Toxicol Lett 190: 91-95. - Koller VJ, Furhacker M, Nersesyan A, Misik M, Eisenbauer M, et al (2012)
Cytotoxic and DNA-damaging properties of glyphosate and Roundup in humanderived
buccal epithelial cells. Arch Toxicol 86: 805-813. - Edginton AN, Sheridan PM, Stephenson GR, Thompson DG, Boermans HJ
(2004) Comparative effects of pH and Vision herbicide on two life stages of four
anuran amphibian species. Environ Toxicol Chem23: 815-822. - Carrasco AE (2012) Personal communication.