Détection de glyphosate chez des porcelets malformés

Auteurs : Monika Krüger1 , Wieland Schrödl1 , Ib Pedersen2 et Awad A Shehata1,3
1 Institut de bactériologie et de mycologie, Faculté de médecine vétérinaire, Université de Leipzig, Allemagne
2 Hvidsten, Danemark
3 Département des maladies aviaires et des lapins, Faculté de médecine vétérinaire, Université de Sadat City, Égypte
Traduction par Sabine Grataloup de la publication Detection of Glyphosate in Malformed Piglets parue dans la revue Environmental & Analytical Toxicology en 2014
AVERTISSEMENT : cette traduction n’est fournie qu’à titre indicatif, le texte de référence de cette étude est celui d’origine en anglais dont le lien est fourni ci-dessus.
Citation: Krüger M, Schrödl W, Pedersen Ib, Shehata AA (2014) Detection of Glyphosate in Malformed Piglets. J Environ Anal Toxicol 4: 230. doi: 10.4172/2161-0525.1000230
Résumé
Les résidus de glyphosate dans différents organes et tissus tels que les poumons, le foie, les reins, le cerveau, la paroi intestinale et le coeur de porcelets danois malformés âgés d’un jour et euthanasiés (N = 38) ont été testés à l’aide du test ELISA.
Tous les organes ou tissus contenaient du glyphosate à des concentrations variables. Les concentrations les plus élevées ont été observées dans les poumons (fourchette de 0,4 à 80 μg/ml) et le coeur (fourchette de 0,15 à 80 μg/ml). Les concentrations les plus faibles ont été détectées dans les muscles (4,4 à 6,4 μg/g).
La détection de telles concentrations de glyphosate chez ces porcelets malformés pourrait être une allusion à la cause de ces anomalies congénitales. Des investigations supplémentaires sont nécessaires de toute urgence pour prouver ou exclure le rôle du glyphosate dans les malformations chez les porcelets et d’autres animaux.
Introduction
Au printemps dernier, un éleveur de porcs danois a apporté 38 porcelets vivants mais malformés âgés d’un jour dans notre laboratoire en raison du pourcentage exceptionnellement élevé de malformations chez les porcelets.
Une hypothèse a été émise quant aux causes possibles de cet incident. Il a été constaté que le taux de malformations augmentait à un sur 260 porcelets nés si l’alimentation des truies contenait 0,87 à 1,13 ppm de glyphosate (Nphosphonométhylglycine) au cours des 40 premiers jours de gestation. Dans le cas d’une teneur de 0,25 ppm de glyphosate dans l’alimentation des truies, un porcelet sur 1 432 présentait une malformation.
Ces porcelets présentaient différentes anomalies telles qu’une atrophie des oreilles, des déformations de la colonne vertébrale et du crâne, un trou dans le crâne et une atrophie des pattes ; chez un porcelet, un oeil n’était pas développé, il n’en avait qu’un seul de grande taille. Des porcelets sans tronc, avec une langue d’éléphant, et des porcelets femelles avec des testicules étaient également présents. Un porcelet malformé présentait un ventre gonflé et l’intestin antérieur et l’intestin postérieur n’étaient pas reliés (figure 1). Différents organes et tissus, tels que les poumons, le foie, les reins, le cerveau, la paroi intestinale et le coeur de porcelets danois âgés d’un jour présentant des malformations et euthanasiés, ont été testés pour détecter la présence de glyphosate à l’aide du test ELISA [1].
Rapidement, les échantillons de tissus ont été hachés en petits morceaux (~0,25 cm). En fonction de leur capacité à retenir l’eau, les échantillons ont été dilués avec de l’eau distillée (Braun, Allemagne). Les échantillons ont été chauffés à 100 °C pendant 10 minutes, homogénéisés et congelés à -80 °C pendant 8 heures. Les échantillons ont été soigneusement décongelés à 40 °C et centrifugés à 10 000 x g pendant 10 minutes. Le surnageant a été filtré à l’aide d’un filtre ultracentrifuge avec une coupure de 3000 Da afin d’éliminer les protéines et les peptides. Les filtrats ont été centrifugés (10 000 x g) à nouveau à 20 °C pendant 10 minutes et le surnageant a été testé pour le glyphosate à l’aide de kits ELISA (Abraxis, États-Unis) conformément au protocole du fabricant.
Des résidus de glyphosate ont été détectés dans les tissus et organes susmentionnés de ces porcelets à différentes concentrations (tableau 1). Tous les organes ou tissus présentaient des concentrations en glyphosate sans différence significative. Les concentrations les plus élevées ont été observées dans les poumons (fourchette de 0,4 à 80 μg/ml) et le coeur (fourchette de 0,15 à 80 μg/ml). Les concentrations les plus faibles ont été détectées dans les muscles (4,4 à 6,4 μg/ml). On suppose que le glyphosate atteint les porcelets par le placenta de leur mère.
Le glyphosate est principalement utilisé pour la gestion des chaumes, le désherbage avant semis et l’application avant récolte (dessiccation) [2]. Le glyphosate est également utilisé pour le désherbage dans les champs de cultures génétiquement modifiées (OGM) comme le soja, le colza, le maïs, le coton, la betterave sucrière, la luzerne, etc., où il est appliqué directement sur les plantes [3].
Le problème en pleine expansion des mauvaises herbes résistantes au glyphosate se traduit par une augmentation constante de la quantité de glyphosate utilisée sur les cultures. Les tiges, les feuilles et les graines du soja résistant au glyphosate sont contaminées par cette substance. De plus, en raison de son utilisation intensive, le glyphosate est fréquemment détecté dans l’eau, la pluie et l’air [4,5].
Récemment, des résidus de glyphosate ont été détectés à différentes concentrations dans l’urine et divers organes de vaches laitières, ainsi que dans l’urine de lièvres, de lapins et d’êtres humains [6]. Le glyphosate et ses herbicides commerciaux affectent gravement les cellules embryonnaires et placentaires, provoquant des dommages mitochondriaux, une nécrose et une mort cellulaire programmée à des doses bien inférieures aux concentrations utilisées en agriculture. Paganelli et al. [7] ont découvert des malformations congénitales chez des embryons de poulet exposés à une concentration de glyphosate de 8 à 12 μM dans la partie injectée. Les phénotypes moléculaires étaient corrélés à une perturbation des mécanismes de développement impliquant la crête neurale, la formation de la ligne médiane embryonnaire et la structuration céphalique induite par le principe actif du glyphosate et non par les adjuvants, en raison d’une altération de la signalisation rétinoïde. Les auteurs ont donné un aperçu des rapports faisant état de malformations chez les enfants de familles vivant à quelques mètres de l’endroit où cet herbicide était pulvérisé. Le risque de malformation chez les embryons humains est très élevé lorsque leurs mères sont contaminées entre la 2e et la 8e semaine de grossesse. Les concentrations de glyphosate détectées dans les organes, les parois intestinales et la viande de ces porcelets suggèrent une corrélation avec le glyphosate. Daruich et ses collègues [8] ont conclu que le glyphosate provoque divers troubles tant chez la femelle parentale que chez la progéniture. L’exposition paternelle au glyphosate est reconnue comme une cause de malformations congénitales par des altérations des cellules germinales induites par les pesticides [9,10].
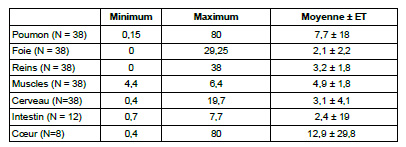
1 Le glyphosate a été détecté à l’aide du test ELISA [1] et les données sont exprimées en μg/g.
Tableau 1 : Résidus de glyphosate dans différents organes de porcelets malformés1 .
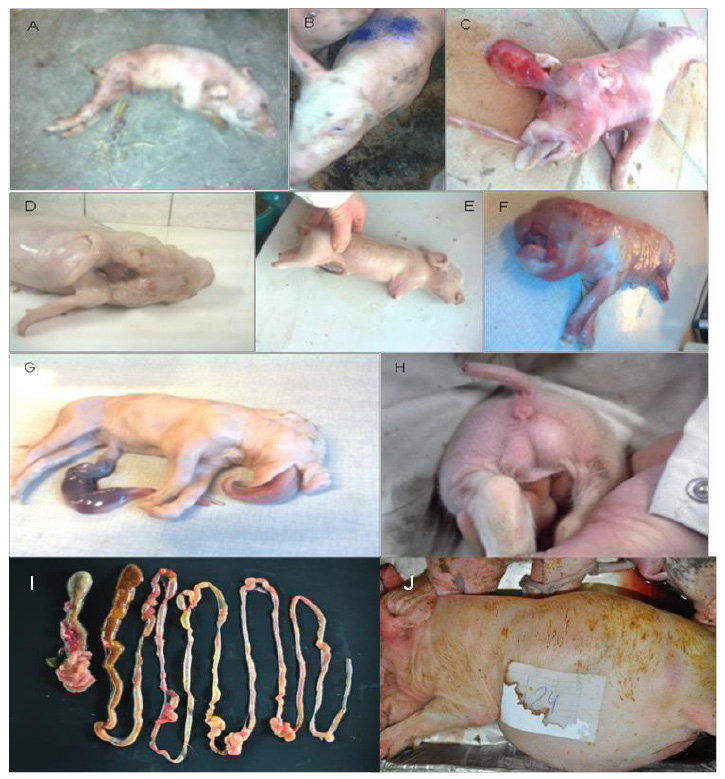
Figure 1 : Sélection de photos de porcelets danois présentant des malformations. A : déformation de la colonne vertébrale, B : oreille non formée, C : déformation crânienne, D : trou dans le crâne, E : porcelets nés vivants avec des pattes courtes et un oeil non développé, F : un grand oeil, une trompe d’éléphant avec des os à l’intérieur, G : langue d’éléphant, H : porcelet femelle avec des testicules, I : intestin antérieur et intestin postérieur du porcelet avec ventre gonflé non reliés, J : porcelet malformé avec ventre gonflé.
En conclusion, le glyphosate pourrait atteindre les animaux par le biais de leur alimentation et est capable de traverser la barrière placentaire. D’autres études sont nécessaires pour confirmer ou exclure le rôle du glyphosate dans les malformations chez les porcelets.
References
- Shehata AA, Schrödl W, Schleddorn P, Krüger (2014) Distribution of glyphosate in chicken organs and its reduction by humic acid. Journal of Veterinary science.
- Dickeduisberg M, Steinmann H, Theuvsen L (2012) Erhebungen zum Einsatz von Glyphosat im deutschen Ackerbau. 25th German conference on weed biology and weed control, 2012, Braunschweig, Germany.
- Duke SO, Powles SB (2008) Glyphosate: a once-in-a-century herbicide. Pest Manag Sci 64: 319-325.
- Chang FC, Simcik MF, Capel PD (2011) Occurrence and fate of the herbicide glyphosate and its degradate aminomethylphosphonic acid in the atmosphere. Environ Toxicol Chem 30: 548-555.
- Van Stempvoort DR, Roy JW, Brown SJ, Bickerton G (2014) Residues of the herbicide glyphosate in riparian groundwater in urban catchments. Chemosphere 95: 455-463.
- Krüger M, Schledorn P, Schrödl W, Hoppe HW, Lutz W, et al. (2014) Detection of Glyphosate Residues in Animals and Humans. J Environ Anal Toxicol 4: 210.
- Paganelli A, Gnazzo V, Acosta H, López SL, Carrasco AE (2010) Glyphosate based herbicides produce teratogenic effects on vertebrates by impairing retinoic acid signaling. Chem Res Toxicol 23: 1586-1595.
- Daruich J, Zirulnik F, Gimenez MS (2001) Effect of the herbicide glyphosate on enzymatic activity in pregnant rats and their fetuses. Environ Res 85: 226-231.
- Savitz DA, Arbuckle T, Kaczor D, Curtis KM (1997) Male pesticide exposure and pregnancy outcome. Am J Epidemiol 146: 1025-1036.
- Mesnage R, Moesch C, Le Grand R, Lauthier G, deVendômois JS, et al. (2012) Glyphosate exposure in a farmer’s family. Journal of Environmental Protection 3: 1001-1003.